题目内容
19.将标准状况下33.6L的二氧化碳气体通入2L 1mol.L-1的氢氧化钠溶液中完全反应后,试通过计算确定:(1)溶液中溶质的成分;
(2)各溶质的物质的量.
分析 氢氧化钠与二氧化碳会发生反应:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,二氧化碳物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,NaOH物质的量为2mol,n(CO2):n(NaOH)=1.5mol:2mol=2:3,介于1:2与1:1之间,两个反应均发生,故反应生成Na2CO3、NaHCO3,根据碳原子、钠离子守恒列方程计算Na2CO3、NaHCO3的物质的量.
解答 解:氢氧化钠与二氧化碳会发生反应:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,二氧化碳物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,NaOH物质的量为2L×1mol/L=2mol,n(CO2):n(NaOH)=1.5mol:2mol=2:3,介于1:2与1:1之间,两个反应均发生,故反应生成Na2CO3、NaHCO3,
设Na2CO3、NaHCO3的物质的量分别为xmol、ymol,由碳原子、钠离子守恒,则:
$\left\{\begin{array}{l}{x+y=1.5}\\{2x+y=2}\end{array}\right.$
解得x=0.5,y=1
答:(1)溶液中溶质为Na2CO3、NaHCO3;
(2)Na2CO3为0.5mol,NaHCO3为1mol.
点评 本题考查化学方程式有关计算,关键是判断产物,侧重考查学生分析计算能力,也可以利用过程法结合过量计算进行计算解答.

练习册系列答案
相关题目
9.根据转化关系判断下列说法正确的是( )


| A. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| B. | 反应②中,1mol葡萄糖可生成3mol乙醇 | |
| C. | 将在空气中灼绕后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应①中,(C6H10O5)n可表示淀粉或纤维素 |
14.体积为V mL,密度为ρ g/mL的含有相对分子质量为M的某物质的溶液,其中溶质为m g,其物质的量浓度为c mol/L,溶质的质量分数为w%,则下列表示正确的是( )
| A. | c=$\frac{1000wρ}{M}$ | B. | m=$\frac{Vρw}{100}$ | C. | w=$\frac{cM}{1000ρ}$% | D. | c=$\frac{m}{VM}$ |
8.在镀锌铁皮的锌镀层厚度的测定过程中,下列操作会导致测定结果偏高的是( )
| A. | 过早判断反应终点 | |
| B. | 在测定铁皮的面积时测得面积比铁皮的实际面积大 | |
| C. | 过迟判断反应终点 | |
| D. | 锌在酸中溶解后,铁皮未烘干就去称重 |
9.下列实验能达到目的是( )
| 序号 | 实验目的 | 实验操作 |
| A | 证明Ksp(AgI)<Ksp(AgCl) | 在AgNO3溶液中滴加少量NaCl溶液,产生白色沉淀,继续滴加少量KI溶液又产生黄色沉淀 |
| B | 阿司匹林的提纯,即除去混有的水杨酸聚合物等杂质 | 将阿司匹林粗品溶解在适量饱和碳酸氢钠溶液中,抽滤后在滤液中加入盐酸,再抽滤并洗涤 |
| C | 检验火柴头中含氯元素 | 往浸过火柴头的溶液中加AgNO3溶液和稀硝酸 |
| D | 加快锌与稀硫酸反应制取H2的速率 | 在稀硫酸中滴加少量Cu(NO3)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
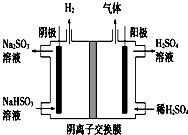 工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阴极电极反应式2H++2e-=H2↑,阳极区逸出气体的成分为O2 SO2(填化学式).
工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阴极电极反应式2H++2e-=H2↑,阳极区逸出气体的成分为O2 SO2(填化学式).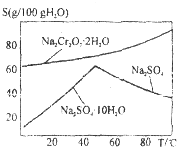 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
 ;
; 结构(含E)的有13种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为
结构(含E)的有13种;E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为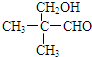 .
.


