题目内容
【题目】钛被称为继铁、铝之后的第三金属,回答下列问题:
(1)金属钛晶胞如图1所示,为___________堆积(填堆积方式)。
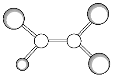
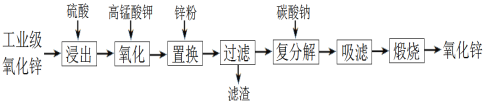
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是________________。
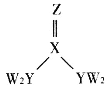
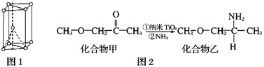
(3)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为_______________。
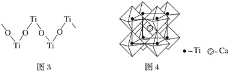
(4)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被__________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被__________个氧离子包围,钙钛矿晶体的化学式为____________。
【答案】六方最密 化合物乙含有N—H键,化合物乙分子间形成氢键 ![]() (或
(或![]() ) 6 12 CaTiO3
) 6 12 CaTiO3
【解析】
(1)Ti原子核电荷数为22,价电子排布式为3d24s2,金属钛晶胞结构为二层相互错开,第三层正对第一层的方式堆积而成的;
(2)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键,故分子间作用力比化合物甲强;
(3)该图中每个Ti原子连接O原子个数=2×![]() =1,即Ti、O原子个数之比为1:1,由此确定其化学式;
=1,即Ti、O原子个数之比为1:1,由此确定其化学式;
(4)钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子,包围着中心的钙离子,可以根据晶胞的均摊原则确定晶胞的化学式。
(1)钛原子的价电子排布式为3d24s2,根据其晶胞结构可知,晶体钛为六方最密堆积形;
(2)化合物乙分子中有-NH2,因此其分子间存在氢键,而化合物甲分子之间只存在分子间作用力,因此化合物乙的沸点比化合物甲高;
(3)该图中每个Ti原子连接O原子个数=2×![]() =1,即Ti、O原子个数之比为1:1,其化学式为(TiO)n2n+(或TiO2+);
=1,即Ti、O原子个数之比为1:1,其化学式为(TiO)n2n+(或TiO2+);
(4)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×![]() =3,则晶胞的化学式为CaTiO3。
=3,则晶胞的化学式为CaTiO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案