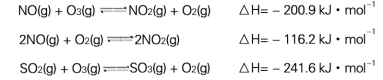题目内容
【题目】硫代硫酸钠(Na2S2O35H2O,式量248)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图1:
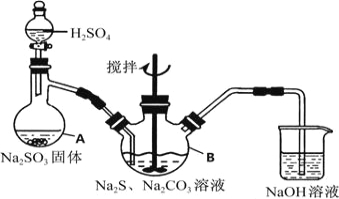
图1
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O35H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称 ,步骤④中洗涤时,为了减少产物的损失的试剂可以
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因
(3)最后得到的产品可能含有Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论
(4)测定产品纯度
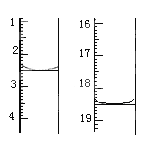
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000molL﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为 mL,产品的纯度为 %
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液中易被Cl2氧化SO42﹣,该反应的离子方程式为. 。
【答案】(1)蒸馏烧瓶,乙醇;(2)S2O32-+2H+=S+SO2↑+H2O;(3)取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,若不出现白色沉淀,说明不含硫酸钠杂质;(4)①16.00,79.36;②偏低;(5)S2O32-+ 4Cl2 + 5H2O = 2SO42- + 8Cl- + 10H+ 。
【解析】
试题分析:(1)仪器A为蒸馏烧瓶,根据题意,硫代硫酸钠易溶于水,难溶于乙醇,因此为了减少产物的损失用乙醇进行洗涤;(2)硫代硫酸钠与酸反应,S2O32-+ 2H+ == S + SO2 ↑+H2O;(3)取样,先加足量的盐酸酸化,过滤,取澄清液体加入氯化钡溶液,若出现白色沉淀,说明含有硫酸钠杂质,若不出现白色沉淀,说明不含硫酸钠杂质;(4)①根据图2,滴定前的读数是2.50mL,滴定后读数是18.50mL,因此消耗碘的体积为(18.50-2.50)mL = 16.00mL,根据离子反应方程式,n(Na2S2O3) = 16.00 × 10-3 × 0.1000 × 2mol = 3.2 × 10-3mol,m(Na2S2O3·5H2O) = 3.2 × 10-3 × 248g = 0.7936g,纯度为0.7936/1 × 100% = 79.36%;②局部变色,说明消耗I2的量减少,求的纯度偏低;(5)根据信息,氯气作氧化剂,转变成Cl-,Na2S2O3作还原剂,被氧化成SO42-,利用化合价的升降法进行配平,其离子反应方程式为:S2O32-+ 4Cl2 + 5H2O == 2SO42- + 8Cl- + 10H+ 。

【题目】如图是周期表中短周期的一部分,已知A、C两种元素的核电荷数之和等于B的核电荷数,下列叙述正确的是( )
A | C | |
B |
A.B为第二周期的元素
B.C为第五主族元素
C.A的原子序数为6
D.C是非金属性最强的元素