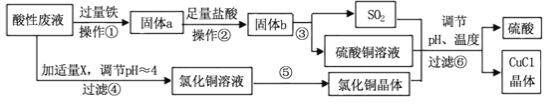
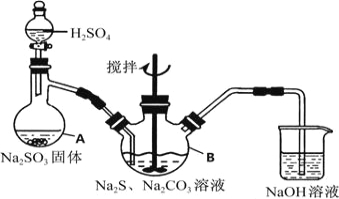
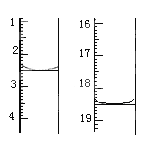
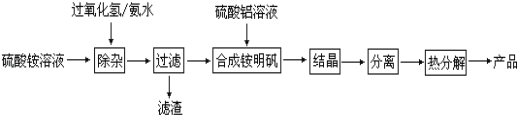
题目内容
【题目】把aLAl2(SO4)3和(NH4)2SO4的混合溶液分成两等份,其中一份加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c molNH3气体,则原溶液中的Al3+离子的浓度(mol/L)为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】A
【解析】
试题分析:加入BaCl2溶液出现沉淀,Ba2++SO42-=BaSO4↓,n(SO42-)=n(BaCl2)=bmol,原溶液中含n(SO42-)=2bmol,加入NaOH溶液,出现NH3,根据N元素守恒,n(NH4+)=n(NH3)=cmol,原溶液n(NH4+)=2cmol,原溶液根据电荷守恒,即有3n(Al3+)+n(NH4+)=2n(SO42-),解得n(Al3+)=(2×2b-2c)/3mol,c(Al3+)=(2×2b-2c)/3amol·L-1,故选项A正确。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目