题目内容
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
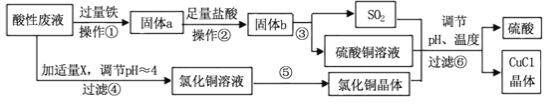
I.污染物SO2、NOx经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:
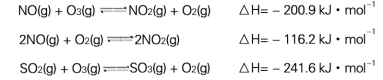
(1) T℃时,反应3NO(g)+O3(g)![]() 3NO2(g)的△H= kJ·mol-1。
3NO2(g)的△H= kJ·mol-1。
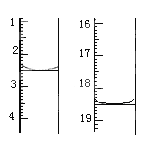
(2) T℃时,将0.6 mol NO和0.2 molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
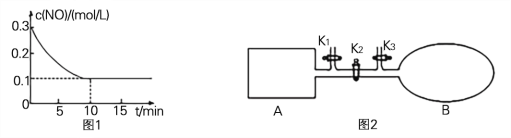
① T℃时,反应3NO(g) +O3 (g) ![]() 3NO2 (g)的平衡常数K= 。
3NO2 (g)的平衡常数K= 。
② 不能说明反应达到平衡状态的是 (填写字母)。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
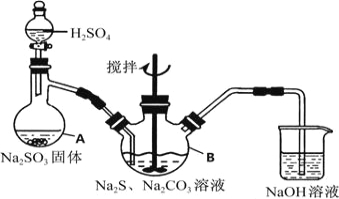
(3) 如图2所示,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
① 容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)= 。
② 平衡后在A容器中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”、“变小”或“不变”) 。
③ 在②平衡后,打开K2,重新到达新平衡,B气囊的体积为0.8aL,则在打开K2之前,气囊B的体积为 L。
【答案】(14分)
(1)-317.1 (2 分)
(2)①240(或240 L·mol-1)(3分) ② C (2分)
(3)① ![]() mol·L-1·s-1 (3分) ②变小 (2分) ③0.6a (2分)
mol·L-1·s-1 (3分) ②变小 (2分) ③0.6a (2分)
【解析】
试题分析:Ⅰ.(1)①NO(g)+O3(g)NO2(g)+O2(g)△H=-200.9kJ.mol-1
②2NO(g)+O2(g)2NO2(g)△H=-116.2kJ.mol-1
①+②得到T℃时,反应3NO (g)+O3(g)3NO2(g)的△H=-317.1KJ/mol,
故答案为:-317.1;
(2)①T℃时,将0.6mol NO和0.2molO3气体充入到2L固定容积的恒温密闭容器中,图象分析可知平衡状态NO浓度为0.1mol/L,10min达到平衡,
3NO (g)+O3(g)3NO2(g)
起始量(mol/L) 0.3 0.1 0
变化量(mol/L) 0.2 0.2/3 0.2
平衡量(mol/L) 0.1 0.1/3 0.2
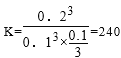 ②反应3NO (g)+O3(g)3NO2(g)的△H=-317.1KJ/mol,反应是气体体积减小的放热反应,
②反应3NO (g)+O3(g)3NO2(g)的△H=-317.1KJ/mol,反应是气体体积减小的放热反应,
A.气体颜色不再改变,说明二氧化氮浓度不变,反应达到平衡状态,故A不符合;
B.反应前后气体质量不变,物质的量变化,当气体的平均摩尔质量不再改变说明反应达到平衡状态,故B不符合;
C.气体质量和体积不变,气体的密度始终不改变,不能说明反应达到平衡状态,故C符合;
D.反应速率之比等于化学方程式计量数之比为正反应速率之比,当单位时间内生成O3和NO2物质的量之比为1:3,表明正逆反应速率相同,反应达到平衡状态,故D不符合;
故答案为:C;
Ⅱ.(3)①关闭K2,将各1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL,若容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,设生成四氧化二氮为x
2NO2(g)N2O4(g)
起始量 1 0
变化量 2x x
平衡量 1-2x x
1-2x+x=0.8×1
x=0.2mol
则平均化学反应速率v(NO2)=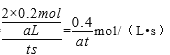
②若平衡后在A容器中再充入0.5mol N2O4,相当于中等压强,平衡正向进行,则重新到达平衡后,平衡混合气中NO2的体积分数变小,故答案为:变小.③打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的.由于此时反应物的物质的量是B中的三倍,所以打开K2之前,气球B体积为(aL+0.8aL)÷3=0.6aL。

 阅读快车系列答案
阅读快车系列答案