题目内容
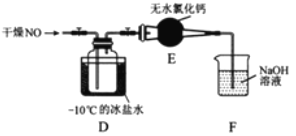
【题目】无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。下图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:

(1)A仪器的名称是_____________________;
(2)B中反应的离子方程式为______________________;其中浓盐酸表现出________性;若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制取Cl2,制得的Cl2体积总是小于1.12 L(标准状况)的原因是______________。
(3)气体通过装置C的目的是________________。
(4)D中的反应开始前,需进行的操作是___________,应采取的方法是__________________。
(5)D中发生反应的化学方程式为__________________________________________。
(6)装置(Ⅰ)的主要缺点是_______________________________________________。
(7)装置(Ⅱ)中F中发生反应的化学方程式为___________________________。如果选用(Ⅱ)装置来完成实验,则必须采取的改进措施是__________________________。
【答案】(球形)分液漏斗 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 酸性和还原性 随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反应停止 吸收水蒸气,干燥氯气 排除装置中的空气 B中的反应进行一段时间后,看到黄绿色气体充满整个装置,再开始加热D 2Fe+3Cl2
Mn2++Cl2↑+2H2O 酸性和还原性 随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反应停止 吸收水蒸气,干燥氯气 排除装置中的空气 B中的反应进行一段时间后,看到黄绿色气体充满整个装置,再开始加热D 2Fe+3Cl2 ![]() 2FeCl3 氯化铁升华后遇冷凝华,导管易被堵塞尾气排入空气,会造成环境污染 2NaOH+Cl2 == NaCl+NaClO+H2O 在瓶E和F之间连接装有干燥剂的装置
2FeCl3 氯化铁升华后遇冷凝华,导管易被堵塞尾气排入空气,会造成环境污染 2NaOH+Cl2 == NaCl+NaClO+H2O 在瓶E和F之间连接装有干燥剂的装置
【解析】
(1)根据实验仪器的特点回答;
(2)B装置中是浓盐酸与二氧化锰制备氯气的发生装置;根据氧化还原反应的规律判断,浓盐酸中氯元素一部分化合价升高,被氧化,做还原剂,另一部分生成盐氯化锰;且浓盐酸可以被二氧化锰氧化为氯气,但稀盐酸与氯化锰不反应,据此分析判断;
(3)浓硫酸具有吸收性,可干燥氯气;
(4)利用生成的氯气排出装置中的空气来分析;
(5)加热条件下,氯气和铁反应生成氯化铁;
(6)导管易被产品堵塞,有毒气体应该有尾气处理装置;
(7)F装置为尾气处理装置,氢氧化钠可吸收氯气,但该尾气处理装置中有水,导致氯化铁易潮解,据此分析作答。
(1)根据图示信息可知,A仪器的名称为(球形)分液漏斗,
故答案为:(球形)分液漏斗;
(2)实验室用氯气和铁反应制取氯化铁,所以首先必须制取氯气,实验室常用浓盐酸和二氧化锰加热制取氯气,加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,所以B中发生的化学反应是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,可以看出,浓盐酸一部分氯原子被氧化为氯气,起还原性作用,另一部分氯原子并没有参与化合价的升降,生成了盐,则浓盐酸在此反应中表现出酸性和还原性。因浓盐酸具有还原性,稀盐酸不和二氧化锰反应,所以随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反应停止,故实际制得的Cl2体积总是小于理论值,
Mn2++Cl2↑+2H2O,可以看出,浓盐酸一部分氯原子被氧化为氯气,起还原性作用,另一部分氯原子并没有参与化合价的升降,生成了盐,则浓盐酸在此反应中表现出酸性和还原性。因浓盐酸具有还原性,稀盐酸不和二氧化锰反应,所以随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反应停止,故实际制得的Cl2体积总是小于理论值,
故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;还原性和酸性;随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反应停止;
Mn2++Cl2↑+2H2O;还原性和酸性;随着反应的进行,浓盐酸的浓度逐渐减小变为稀盐酸,反应停止;
(3)为达到实验目的,需制备无水氯气,则用浓硫酸吸收氯气中的水蒸气,干燥氯气,
答案为:吸收水蒸气,干燥氯气;
(4)D中的反应开始前,需排除装置中的空气,防止氧气和铁反应生成铁的氧化物而产生杂质,所以D中的反应开始前,必须排除装置中的空气,其方法是B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D,
故答案为:B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D;、
(5)D为干燥的氯气与铁粉反应生成无水氯化铁的反应,发生反应的化学方程式为2Fe+3Cl2 ![]() 2FeCl3,
2FeCl3,
故答案为:2Fe+3Cl2 ![]() 2FeCl3;
2FeCl3;
(6)导气管口较小,D装置中的固体物质易堵塞导管口;氯气是有毒气体,不能直接排空,否则会污染环境,所以应该有一个尾气处理装置,
故答案为:氯化铁升华后遇冷凝华,导管易被堵塞尾气排入空气,会造成环境污染
(7)该装置中有尾气处理装置,其内部发生的化学反应为:2NaOH+Cl2 == NaCl+NaClO+H2O,但尾气处理装置中是水溶液,会导致E中有水蒸气,会导致氯化铁产品易潮解,所以为防止氯化铁潮解,在瓶E和F之间连接装有干燥剂的装置,
故答案为:2NaOH+Cl2 == NaCl+NaClO+H2O;在瓶E和F之间连接装有干燥剂的装置。

 阶梯计算系列答案
阶梯计算系列答案【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②