��Ŀ����
ƫ��������N2O4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��
��CH3��2NNH2��l��+2N2O4��1��=2CO2��g��+3N2��g��+4H2O��g������I��
��1����Ӧ��I������������ ��
��2������к��г��ֺ���ɫ���壬ԭ��Ϊ��N2O4��g���T2NO2��g�� ����
���¶�����ʱ��������ɫ�����Ӧ����Ϊ ������ȡ����ȡ�����Ӧ��
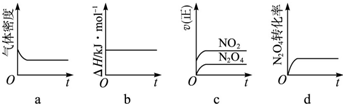
��3��һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1molN2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬���� ��
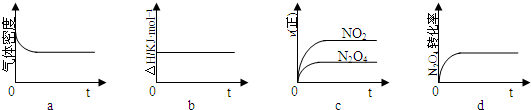
������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ�� ������������䡱��С��������Ӧ3s��NO2�����ʵ���Ϊ0.6mol����0��3s��ƽ����Ӧ����v��N2O4��= mol?L-1?s-1��
��4�����᳧��β���к�NO2��NO��ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ����������ﻹԭΪ������ˮ����Ӧ����Ϊ��
CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H=-574kJ?mol-1
CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=-1160kJ?mol-1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ�� ��
��5�������ڴ�����ȼ�գ�Ҳ������������Ӧ��I�������е����֣���ѧ�����ô�ԭ������Ƴɰ���-����ȼ�ϵ�أ���ͨ�백���ĵ缫�� ����������������������������£��õ缫������Ӧ�ĵ缫��ӦʽΪ ��
��CH3��2NNH2��l��+2N2O4��1��=2CO2��g��+3N2��g��+4H2O��g������I��
��1����Ӧ��I������������
��2������к��г��ֺ���ɫ���壬ԭ��Ϊ��N2O4��g���T2NO2��g�� ����
���¶�����ʱ��������ɫ�����Ӧ����Ϊ
��3��һ���¶��£���Ӧ�����ʱ�Ϊ��H���ֽ�1molN2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����
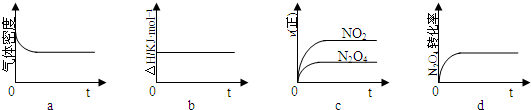
������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ��
��4�����᳧��β���к�NO2��NO��ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ����������ﻹԭΪ������ˮ����Ӧ����Ϊ��
CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H=-574kJ?mol-1
CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=-1160kJ?mol-1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��
��5�������ڴ�����ȼ�գ�Ҳ������������Ӧ��I�������е����֣���ѧ�����ô�ԭ������Ƴɰ���-����ȼ�ϵ�أ���ͨ�백���ĵ缫��
��������1����������ԭ��Ӧ�л��ϼ۽��͵ķ�Ӧ������������
��2�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
��3�����ݴﵽƽ��״̬�������Ũ�Ȳ��䣬���淴Ӧ������Ƚ����жϣ���ѧƽ�ⳣ��ֻ���¶��йأ������ʵ�Ũ���أ�����v��NO2��=
����NO2�Ļ�ѧ��Ӧ���ʣ��ٸ���ͬһ��Ӧ�С�ͬһʱ����ڷ�Ӧ����֮�ȵ��ڼ�����֮�ȼ���v��N2O4����
��4�����ݸ�˹���������㷴Ӧ���ʱ䣬������д�Ȼ�ѧ����ʽ��
��5������ȼ�ϵ���У�ȼ���������������������������ĵ缫��Ӧ=�ܷ�Ӧ-�����ĵ缫��Ӧ��
��2�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
��3�����ݴﵽƽ��״̬�������Ũ�Ȳ��䣬���淴Ӧ������Ƚ����жϣ���ѧƽ�ⳣ��ֻ���¶��йأ������ʵ�Ũ���أ�����v��NO2��=
| ��c |
| ��t |
��4�����ݸ�˹���������㷴Ӧ���ʱ䣬������д�Ȼ�ѧ����ʽ��
��5������ȼ�ϵ���У�ȼ���������������������������ĵ缫��Ӧ=�ܷ�Ӧ-�����ĵ缫��Ӧ��
����⣺��1����Ӧ�����У�N2O4��l����NԪ�صõ��ӻ��ϼ۽��ͣ�N2O4��l��������������CH3��2NNH2��l����̼Ԫ�ػ��ϼ����ߣ��ǻ�ԭ����
�ʴ�Ϊ��N2O4��
��2�������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ������¶�����ʱ��������ɫ���ƽ��������Ӧ�����ƶ�����������Ӧ�����ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��3��a����Ӧ����ʽ�����������������ȣ��ܶȲ��䣬˵���ﵽ��ƽ��״̬����a��ȷ��
b����Ӧ�����У���Ӧ�Ȳ���仯�����DZ��������ж��Ƿ�ﵽƽ��״̬����b����
c�����ݷ�Ӧ���ʴ�С�����ж����淴Ӧ�����Ƿ���ȣ���c����
d��������������ת���ʲ��䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����d��ȷ��
��ѧƽ�ⳣ��ֻ���¶��йأ������ʵ�Ũ���أ�����ƽ�ⳣ��K���䣻
v��NO2��=v��NO2��=
=
=0.2mol/L?s����v��N2O4��=
v��NO2��=0.1mol/��L?s����
�ʴ�Ϊ��ad�����䣻0.1��
��4����֪����CH4��g��+4NO2��g����4NO��g��+CO2��g��+2H2O��g����H=-574kJ?mol-1��
��CH4��g��+4NO��g����2N2��g��+CO2��g��+2H2O��g����H=-1160kJ?mol-1��
����ֱ�ӽ�NO2��ԭΪN2�Ļ�ѧ����ʽ��CH4+2NO2=CO2+N2��������
����+�ڣ��õ���
���Լ���ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol��
�ʴ�Ϊ��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol��
��5��ȼ�ϵ���У�ȼ������������ͨ�백���ĵ缫�Ǹ��������������£��ܷ�Ӧ��4NH3+3O2
2N2+6H2O�������ĵ缫��Ӧ��3O2��+6H2O+12e-=12OH-�������ĵ缫��ӦʽΪ��4NH3+12OH--12e=2N2+12H2O��
�ʴ�Ϊ��������4NH3+12OH--12e=2N2+12H2O��
�ʴ�Ϊ��N2O4��
��2�������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ������¶�����ʱ��������ɫ���ƽ��������Ӧ�����ƶ�����������Ӧ�����ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��3��a����Ӧ����ʽ�����������������ȣ��ܶȲ��䣬˵���ﵽ��ƽ��״̬����a��ȷ��
b����Ӧ�����У���Ӧ�Ȳ���仯�����DZ��������ж��Ƿ�ﵽƽ��״̬����b����
c�����ݷ�Ӧ���ʴ�С�����ж����淴Ӧ�����Ƿ���ȣ���c����
d��������������ת���ʲ��䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����d��ȷ��
��ѧƽ�ⳣ��ֻ���¶��йأ������ʵ�Ũ���أ�����ƽ�ⳣ��K���䣻
v��NO2��=v��NO2��=
| ��c |
| ��t |
| ||
| 3s |
| 1 |
| 2 |
�ʴ�Ϊ��ad�����䣻0.1��
��4����֪����CH4��g��+4NO2��g����4NO��g��+CO2��g��+2H2O��g����H=-574kJ?mol-1��
��CH4��g��+4NO��g����2N2��g��+CO2��g��+2H2O��g����H=-1160kJ?mol-1��
����ֱ�ӽ�NO2��ԭΪN2�Ļ�ѧ����ʽ��CH4+2NO2=CO2+N2��������
| 1 |
| 2 |
���Լ���ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol��
�ʴ�Ϊ��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol��
��5��ȼ�ϵ���У�ȼ������������ͨ�백���ĵ缫�Ǹ��������������£��ܷ�Ӧ��4NH3+3O2
| ||
�ʴ�Ϊ��������4NH3+12OH--12e=2N2+12H2O��
���������⿼���˻�ѧƽ��״̬���жϡ���ѧ��Ӧ���ʵļ��㡢�Ȼ�ѧ����ʽ����д��֪ʶ����Ŀ�Ѷ��еȣ�ע�����ջ�ѧƽ��״̬���жϷ�������ȷ��ѧ��Ӧ�����뻯ѧ�������������ȣ�����������ѧ�����Ӧ����ѧ֪ʶ��������

��ϰ��ϵ�д�
�����Ŀ