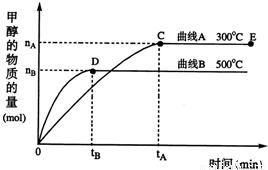
题目内容
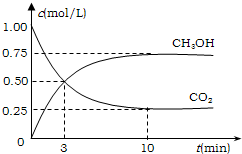 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.①从反应开始到平衡,氢气的平均反应速率v(H2)=
②氢气的转化率=
③该反应的平衡常数为
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol CO2和3mol H2.
| △c |
| △t |
②根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
③根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
④要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动.
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2.25mol/L |
| 10min |
故答案为:0.225;
②氢气的转化率=
| 2.25 |
| 3 |
故答案为:75%;
②平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 0.75×0.75 |
| 0.25×0.753 |
故答案为:5.33;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD.

“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O?
当反应中有2.408×1024个电子发生转移时,还原剂的质量为 ????????????
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | x | 2.0 | 1.6 | 2.4 | 6 |
2 | 900 | 2.0 | 1.0 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为?? ???? ?? (要求2位有效数字,下同);实验2达到平衡时CO的体积分数为?? ????? ???? 。
②若反应的平衡常数大,处理CO的效率高,则增大该反应平衡常数的措施有????????? 。
③900℃时,该密闭容器中,加入4 molCO,3 mol H2O ,4mol CO2和2.4mol H2,比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
④一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的有?? ? 。?
A.容器中气体的平均分子量不随时间而变化???
B.消耗1molH2的同时消耗1molCO
C.容器中气体的密度不随时间而变化?????????
D.CO2的体积分数不随时间而变化????
(3)汽车尾气的排放对空气造成污染。目前采用的是在汽车排气装置中安装一个净化器,可以有效将尾气中的有害气体转化。如:
① CO (g)+NO2(g) =CO2(g) + NO (g)?? ΔH =-a kJ/mol?? (a>0)
②? 2CO (g)+2NO(g) =2CO2(g) )+ N2 (g)?? ΔH =-b kJ/mol? (b>0)
若用标准状况下3.36LCO还原NO2至N2(CO完全反应)时放出的热量为??? ??? kJ(用含a和b的代数式表示,下同);并写出该反应的热化学方程式???????????????????????????????? 。
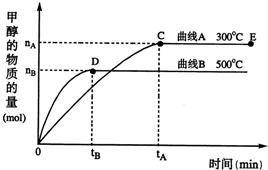 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CH3OH(g)
CH3OH(g)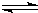 2Cu+CO2
2Cu+CO2
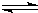


 CO2(g) +H2(g) △H=-42KJ/mol
CO2(g) +H2(g) △H=-42KJ/mol 
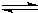 CH3OH(g)
CH3OH(g) ,下列有关该体系的说法正确的是______
,下列有关该体系的说法正确的是______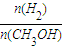 增大
增大