��Ŀ����
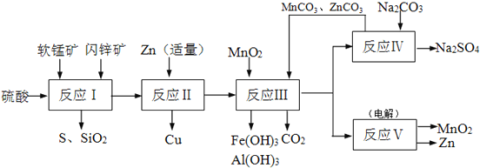
����Ŀ��п�̸ɵ���Ǻܹ��ϵ�һ���Ե�أ���������ԭ����Ҫ�����̿����п����֪��п���к�ZnSԼ80%��FeS��CuS��SiO2��Լ7%������Ϊˮ�֣����̿��к�MnO2Լa%��SiO2Լ20%��Al2O3Լ4%������Ϊˮ�֡�������Ա�������ۺ��������̿����п���ͬ��������գ�������������ͼ��ʾ��
��ش��������⣺
(1)��ӦI�費�Ͻ��裬Ŀ����____________________________��
(2)���鷴ӦI����Һ�к���Fe3+���Լ�Ϊ____________��д����ӦI����FeS����Fe3+�����ӷ���ʽ____________________________________��
(3)��Ӧ���������п��������__________________����ӦIII��MnO2��������________________��
(4)��֪ZnCO3��MnCO3��Ksp�ֱ�Ϊ1.4��10-10��2.2��10-11��Ҫʹ��ӦIV֮�����Һ��Zn2+��Mn2+Ũ�Ⱦ�����1.0��10-6mol/L������Һ�в�����CO32-Ũ������Ϊ__________mol/L��
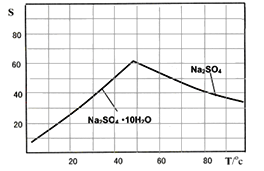
(5)ͼ��Na2SO4��Na2SO410H2O���ܽ� ������(g/100gˮ)������еõ�Na2SO4����IJ����ǣ��������MnCO3��ZnCO3�����Һ________��__________�� ���Ҵ�ϴ����������Ҵ�ϴ�Ӷ�����ˮϴ��ԭ����_________________________________________��
���𰸡��ӿ췴Ӧ���ʣ����ԭ�������ʡ� KSCN(��) 2FeS+3MnO2+12H+ =2Fe3+ +2S+3Mn2+ +6H2O ����Һ�е�Cu2+��ԭ��Cu ��Fe2+������Fe3+ 1.4��10-4 �����ᾧ ���ȹ��� ��ֹNa2SO4����ת��ΪNa2SO410H2O������ֹNa2SO4������ˮ�����
��������
��1����ӦI����п�����̿��������е��ܽ���̣�������Ϊ�˼ӿ췴Ӧ���ʣ����ԭ�������ʣ�
��2����Һ���Ƿ���Fe3+�������Լ�һ��ѡ��KSCN(��)����ӦI����FeS��MnO2��������Һ�з�Ӧ����Fe3+��H2O��S��Mn2+��
��3����ͼ��֪����Ӧ���������п��ͭ�������ʷ�Ӧ���ǽ���Һ�е�Cu2+��ԭΪCu����ӦIII�м���MnO2����Fe2+������Fe3+����������Fe(OH)3������
��4����ʹZn2+��Mn2+Ũ�Ⱦ�����1.0��10-6mol/L������ZnCO3��MnCO3�ܶȻ�����������CO32-Ũ�ȣ�
��5����ͼ���ܽ�����߱仯��֪��Na2SO4���ܽ�ȣ����¶Ƚϸ�ʱ�����¶����߶����ͣ���Na2SO410H2O���ܽ�ȣ����¶����߶����������õ�Na2SO4���壬Ӧ��ȡ���������ܼ�ʹNa2SO4�ᾧ�����������ȹ��ˣ���Na2SO4���Ҵ��������ܽ⣬�������Ҵ�������ˮϴ�ӣ�����ֹNa2SO4��ˮ��������Na2SO410H2O�����ܷ�ֹNa2SO4������ˮ����ġ�
��1����ӦI����п�����̿��������е��ܽ���̣�������Ϊ�˼ӿ췴Ӧ���ʣ����ԭ�������ʣ�
�����Ϊ���ӿ췴Ӧ���ʣ����ԭ�������ʡ�
��2��Fe3+����KSCN��Һ���Ѫ��ɫ��Fe3+����������Һ����ɫ����������I����Һ�к���Fe3+���Լ�Ϊ��KSCN(��)����ӦI����FeS��MnO2��������Һ�з�Ӧ����Fe3+��H2O��S��Mn2+����Ӧ�ĵ����ӷ���ʽΪ��2FeS+3MnO2+12H+ =2Fe3+ +2S+3Mn2+ +6H2O��
�������KSCN(��)��2FeS+3MnO2+12H+ =2Fe3+ +2S+3Mn2+ +6H2O��
��3����ͼ��֪����Ӧ���������п��ͭ�������ʷ�Ӧ���ǽ���Һ�е�Cu2+��ԭΪCu����ӦIII�м���MnO2����Fe2+������Fe3+����������Fe(OH)3������
�����Ϊ������Һ�е�Cu2+��ԭ��Cu����Fe2+������Fe3+��
��4����ʹZn2+��Mn2+Ũ�Ⱦ�����1.0��10-6mol/L������ZnCO3��Ksp=1.4��10-10����c(Zn2+)c(CO32-)=1.4��10-10����ã�c(CO32-)=1.4��10-10����1.0��10-6��=1.4![]() mol/L��ͬ������ʹMn2+��������Mn2+Ũ�Ⱦ�����1.0��10-6mol/Lʱ��c(CO32-)=2.2
mol/L��ͬ������ʹMn2+��������Mn2+Ũ�Ⱦ�����1.0��10-6mol/Lʱ��c(CO32-)=2.2![]() mol/L��������Һ�в�����CO32-Ũ������Ϊ1.4
mol/L��������Һ�в�����CO32-Ũ������Ϊ1.4![]() mol/L ��
mol/L ��
�������1.4![]() ��
��
��5����ͼ���ܽ�����߱仯��֪��Na2SO4���ܽ�ȣ����¶Ƚϸ�ʱ�����¶����߶����ͣ���Na2SO410H2O���ܽ�ȣ����¶����߶����������õ�Na2SO4���壬Ӧ��ȡ���������ܼ�ʹNa2SO4�ᾧ�����������ȹ��ˣ���Na2SO4���Ҵ��������ܽ⣬�������Ҵ�ϴ�Ӽ���ֹNa2SO4��ˮ��������Na2SO410H2O�����ܷ�ֹNa2SO4������ˮ����ģ�
�����Ϊ�������ᾧ �����ȹ��ˡ���ֹNa2SO4����ת��ΪNa2SO410H2O������ֹNa2SO4������ˮ����ġ�

����Ŀ����һ������SO2(g)��O2(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ���õ����±��е��������ݣ���֪2SO2(g)+ O2(g) ![]() 2SO3(g) ��H��0
2SO3(g) ��H��0
ʵ�� ��� | �¶�/�� | ƽ�ⳣ�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
����˵���в���ȷ����
A. x��2.4
B. T1��T2�Ĺ�ϵ��T1��T2
C. K1��K2�Ĺ�ϵ��K2��K1
D. ʵ��1��ǰ6 min�ķ�Ӧ����v(SO2)��0.2 mol��L��1��min��1
����Ŀ��(1)��H2O2��H2SO4 �Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ����֪��Cu(s) +2H+(aq) =Cu2+(aq) +H2(g) ��H=64kJ/mol��2H2O2(l)=2H2O(l)+O2(g) ��H= -196kJ/mol��H2(g)+1/2O2(g)=H2O(l) ��H= -286kJ/mol.��H2SO4��Һ��Cu��H2O2��Ӧ����Cu2+��H2O���Ȼ�ѧ����ʽΪ___________��
(2)��������������ͬ��ӡˢ��·��Ľ�����ĩ��10�GH2O2��3.0 mol/L��H2SO4�����Һ��������ò�ͬ�¶���ͭ��ƽ���ܽ�����(���±�)��
�� ��(��) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
ͭƽ���ܽ�������10-3mol.L-1.min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
���¶ȸ���40��ʱ��ͭ��ƽ���ܽ��������ŷ�Ӧ�¶����߶��½�������Ҫԭ����______________��
(3)���ᴿ���CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ�����ȣ�����CuCl�������Ʊ�CuCl�����ӷ���ʽ��_________________________��
����Ŀ���״���һ�ֿ�������Դ����CO2�Ʊ��״��Ĺ��̿����漰�ķ�Ӧ���£�
��Ӧ����CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=��49.58 kJmol��1
CH3OH(g)+H2O(g) ��H1=��49.58 kJmol��1
��Ӧ����CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ����CO(g)+2H2(g)![]() CH3OH(g) ��H3=��90.77 kJmol��1
CH3OH(g) ��H3=��90.77 kJmol��1
�ش��������⣺
(1)��Ӧ��ġ�H2=_________������Ӧ����������ƽ�ⳣ���ֱ�ΪK1��K2��K3����K2=________(��K1��K3��ʾ)��
(2)��Ӧ���Է�����������___________(�����ϵ��¶��������ϸ��¶��������κ��¶���)��
(3)��һ��������2 L�����ܱ������г���3 mol H2��1.5 mol CO2����������Ӧ��ʵ���ò�ͬ��Ӧ�¶�����ϵ��CO2��ƽ��ת���ʵĹ�ϵ�����±���ʾ��
�¶�(��) | 500 | T |
CO2��ƽ��ת���� | 60�G | 40�G |
��T______500��(����>������<�� ����=��)��
���¶�Ϊ500��ʱ���÷�Ӧ10 minʱ�ﵽƽ�⡣��H2��ʾ�÷�Ӧ�ķ�Ӧ����v(H2)=______________�����¶��£���ӦI��ƽ�ⳣ��K=______________L2/mol2
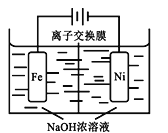
(4)��CO2�Ʊ��״�����Ҫ��������ҵ���õ�ⷨ��ȡNa2FeO4��ͬʱ���������Fe+2H2O+2OH![]() FeO42+3H2��������ԭ����ͼ��ʾ�����һ��ʱ���c(OH)���͵�������__________ (������������������������)�����ҷ����ĵ缫��ӦʽΪ��___________________________��
FeO42+3H2��������ԭ����ͼ��ʾ�����һ��ʱ���c(OH)���͵�������__________ (������������������������)�����ҷ����ĵ缫��ӦʽΪ��___________________________��