题目内容
【题目】Ⅰ.现有下列4种重要的有机物:
①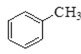 ②
②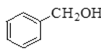 ③
③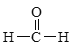 ④
④![]()
请回答:
(1)能与苯酚缩合成高分子化合物的是__________。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2OHCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH)=______mol·L-1。
【答案】③ ①②③ ![]() +NaOH
+NaOH![]()
![]() 锌块 Fe3++3H2OFe(OH)3+3H+ C 10-12
锌块 Fe3++3H2OFe(OH)3+3H+ C 10-12
【解析】
①为甲苯,其属于苯的同系物;②为苯甲醇,其属于芳香醇;③为甲醛,其属于饱和一元醛;④属于卤代烃。通常用牺牲阳极的阴极保护法保护船体。用平衡移动原理分析各物质对化学平衡的影响。
I.(1)能与苯酚缩合成高分子化合物的是甲醛,其合成的高分子为酚醛树脂。答案为③。
(2)甲苯分子中,与苯环直接相连的碳原子上有H;苯甲醇分子中,与苯环直接相连的碳原子上有H,且还有羟基;甲醛分子中有醛基。具有以上这些结构特点的有机物,都能使酸性高锰酸钾溶液褪色,因此,能使酸性高锰酸钾溶液褪色的是①②③。
(3)④在强碱的醇溶液中共热可以发生消去反应生成丙烯,该反应的化学方程式为![]() +NaOH
+NaOH![]()
![]() 。
。
Ⅱ.(1)海水会腐蚀铁质海轮外壳,为了防止其受海水的腐蚀,通常要在船体上连接较活泼的金属(比铁活泼),制造海轮时会在船底四周镶嵌锌块。
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是利用Fe3+的水解产物氢氧化铁胶体吸附水中的悬浮杂质,Fe3+水解的离子方程式为Fe3++3H2OFe(OH)3+3H+。
(3)自来水常用氯气杀菌消毒,Cl2+H2OHCl+HClO,要增大HClO的浓度,应设法让化学平衡向正反应方向移动,且不能消耗HClO。
A.NaOH与产物中的两种酸均可发生中和反应,A不合适;
B.浓HCl可以增大溶液中的氢离子浓度和氯离子浓度,使化学平衡向逆反应方向移动,B不合适;
C.CaCO3固体可以与盐酸反应,但其不与次氯酸反应,可以使化学平衡向正反应方向移动,C合适;
D.加入H2O不能增大次氯酸的浓度,D不合适;
E.SO2消耗氯气和次氯酸,不能增大次氯酸的浓度,E不合适。
综上所述,可以加入CaCO3固体,答案为C。
(4)常温下,0.01mol·L-1NaOH溶液,c(OH)=0.01mol·L-1,由水电离出的c(OH)=c(H+) 110-12 mol·L-1。
110-12 mol·L-1。

 阅读快车系列答案
阅读快车系列答案【题目】下列图像能说明或反映其对应关系的是( )
|
|
|
|
A | B | C | D |
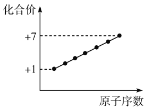
A.第二周期元素的化合价变化
B.第ⅦA族元素简单阴离子的半径变化
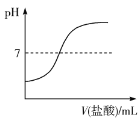
C.向50 mL 0.5mol·L-1NaOH溶液中逐滴加入等浓度盐酸时溶液的pH变化
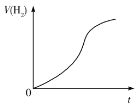
D.Al与稀硫酸反应产生H2的体积变化