题目内容
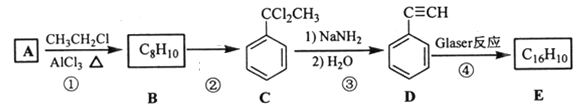
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯催化脱氢来制取苯乙烯:
![]() (g)
(g)![]() (g)+H2(g) H=117.6kJ/mol
(g)+H2(g) H=117.6kJ/mol
已知:上述反应的速率方程为v正=k正P乙苯,v逆=k逆P苯乙烯P氢气,其中k正、k逆分别为正、逆反应速率常数,P为各组分分压。
(1)同时增大乙苯的反应速率和平衡转化率所采取的措施是_______________。
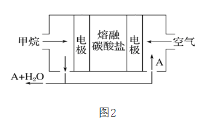
(2)在CO2气氛下,乙苯可催化脱氢制苯乙烯,其过程同时存在如图两种途径:

a=______;与掺水蒸汽工艺相比,该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有__________(填序号)。
a.CO2与H2反应,使乙苯脱氢反应的化学平衡右移
b.不用高温水蒸气,可降低能量消耗
c.有利于减少生产过程中可能产生的积炭
d.CO2在反应体系中作催化剂
(3)在实际生产中,往反应釜中同时通入乙苯和水蒸气,加入水蒸气稀释剂能提高乙苯转化率的原因是_______________。测得容器总压(P总)和乙苯转化率α随时间变化结果如图所示。平衡时,P(H2O)=_______kPa,平衡常数Kp=____kPa(用平衡分压代替平衡浓度计算);a处的![]() =_________。
=_________。
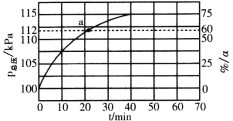
【答案】升温 159.2 abc 体系总压不变时,加入水蒸气,相当于反应体系减压,平衡正向移动,乙苯转化率增大 80 45 2.5
【解析】
(1)结合影响化学反应速率和平衡移动的因素分析判断;
(2)①由图片可知△H1=△H2+△H3,据此计算解答;a.CO2与H2反应,导致氢气浓度减低,结合平衡的移动判断;b.在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;c.结合反应CO2+C═2CO分析判断;d. 根据图示,二氧化碳反应生成了CO,据此分析判断;
(3)根据加入水蒸气对平衡移动的影响分析解答;设起始时n(乙苯)=amol,n(H2O)=bmol,利用反应的三段式计算平衡时气体的总物质的量,结合恒温恒容时,气体的物质的量之比等于压强之比,得到a、b的关系,再计算乙苯、苯乙烯、氢气的分压,并代入Kp=![]() 计算Kp;反应速率v=v正-v逆=k正p乙苯=k逆p苯乙烯p氢气,则v正=k正p乙苯,v逆=k逆p苯乙烯p氢气,平衡时v正=v逆,即k正p乙苯=k逆p苯乙烯p氢气,利用反应的三段式计算a点时气体的总物质的量和分压计算。
计算Kp;反应速率v=v正-v逆=k正p乙苯=k逆p苯乙烯p氢气,则v正=k正p乙苯,v逆=k逆p苯乙烯p氢气,平衡时v正=v逆,即k正p乙苯=k逆p苯乙烯p氢气,利用反应的三段式计算a点时气体的总物质的量和分压计算。
(1)乙苯催化脱氢反应正向是体积增大的吸热反应,同时增大乙苯的反应速率和平衡转化率所采取的措施有升温、加压,故答案为:升高温度(或增大压强);
(2)①由图片可知△H1=△H2+△H3=+117.6kJ/mol+(+41.6kJ/mol)=+159.2kJ/mol,即a=+159.2;a.CO2与H2反应,导致氢气浓度减低,有利于乙苯脱氢反应的化学平衡右移,故a正确;b.由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少,故b正确;c.加入的二氧化碳会发生反应CO2+C═2CO,有利于减少积炭,故c正确;d. 根据图示,二氧化碳反应生成了CO,不是催化剂,故d错误;故答案为:+159.2;abc;
(3) 体系总压不变时,加入水蒸气,相当于反应体系减压,平衡正向移动,乙苯转化率增大,因此在实际生产中,往反应釜中同时通入乙苯和水蒸气,能提高乙苯转化率;设起始时n(乙苯)=amol,n(H2O)=bmol,
 (g)+H2(g)
(g)+H2(g)
起始量(mol) a 00
变化量(mol)0.75a0.75a0.75a
平衡量(mol)0.25a0.75a 0.75a
气体的物质的量之比等于压强之比,平衡时![]() =
=![]() ,b=4a,PH2O=
,b=4a,PH2O=![]() ×115kPa=80kPa,PH2=P苯乙烯=
×115kPa=80kPa,PH2=P苯乙烯=![]() ×115kPa=15kPa,P乙苯=
×115kPa=15kPa,P乙苯=![]() P苯乙烯=5kPa,所以平衡常数Kp=
P苯乙烯=5kPa,所以平衡常数Kp=![]() =
=![]() =45kPa;
=45kPa;
反应速率v=v正-v逆=k正p乙苯-k逆p苯乙烯p氢气,则v正=k正p乙苯,v逆=k逆p苯乙烯p氢气,平衡时v正=v逆,即k正p乙苯-k逆p苯乙烯p氢气,所以![]() =
=![]() =Kp=45kPa;
=Kp=45kPa;
 (g)+H2(g)
(g)+H2(g)
起始量(mol) a 0 0
变化量(mol)0.6a 0.6a 0.6a
平衡量(mol)0.4a 0.6a 0.6a
气体的物质的量之比等于压强之比,a点时PH2=P苯乙烯=![]() ×112kPa=12kPa,P乙苯=8kPa,所以
×112kPa=12kPa,P乙苯=8kPa,所以![]() =Kp×
=Kp×![]() =45kPa×
=45kPa×![]() =2.5,故答案为:体系总压不变时,加入水蒸气,相当于反应体系减压,平衡正向移动,乙苯转化率增大;80;45;2.5。
=2.5,故答案为:体系总压不变时,加入水蒸气,相当于反应体系减压,平衡正向移动,乙苯转化率增大;80;45;2.5。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】利用如图装置可以进行实验并能达到实验目的的是( )

选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用KMnO4和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与浓硝酸制取并收集纯净干燥的NO2 | 水 | 浓硫酸 |
C | 用生石灰与浓氨水制取并收集纯净干燥的NH3 | 水 | 浓硫酸 |
D | 用铜片和浓硫酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
A.AB.BC.CD.D