题目内容
18.氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法.某氧化还 原滴定的反应体系中有反应物和生成物共六种,MnSO4、KMnO4、K2SO4、H2SO3、H2SO3、H2O,其中H2SO3的还原性最强,KMnO4的氧化性最强.对此反应体系:(1)被氧化的元素是+4价的S;发生还原反应的过程是KMnO4→MnSO4.
(2)请用这六种物质组织一个合理的化学反应,写出它的离子方程式:2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O
(3)反应中H2SO4是BC (填编号)
A,氧化剂 B.氧化产物 C.生成物 D.反应物
(4)当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是0.01NA.
(5)用标准KMnO4溶液滴定H2SO3时,滴定终点时颜色变化是溶液由无色变为紫红色,且半分钟内不变色.
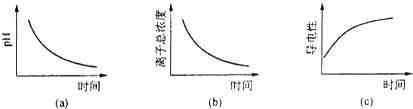
(6)滴定过程中.下列图象所表示的关系正确的是(a)(c)(填编号).
分析 (1)H2SO3的还原性最强,KMnO4的氧化性最强,反应中S的化合价升高,Mn的化合价降低;
(2)H2SO3的还原性最强,反应中做为还原剂,KMnO4的氧化性最强,反应中做为氧化剂,根据化合价的变化配平方程式;
(3)根据S元素的化合价变化判断;
(4)根据离子方程式分析,2molMnO4-转移电子数为10N A电子,求出高锰酸钾的物质的量再计算电子转移;
(5)高锰酸钾为紫色溶液,反应生成为无色的MnSO4,根据高锰酸钾的量的变化判断颜色变化;
(6)由反应方程式可知,反应后氢离子浓度增大,溶液导电性增强.
解答 解:(1)已知H2SO3的还原性最强,KMnO4的氧化性最强,反应中S的化合价升高,Mn的化合价降低,则H2SO3与KMnO4是反应物,MnSO4、K2SO4、H2SO4是生成物,所以反应的离子方程式为:2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O,则被氧化的是+4价的S,发生还原反应的过程是 KMnO4→MnSO4.
故答案为:+4价的S;KMnO4→MnSO4;
(2)由(1)分析可知反应的离子方程式为:2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O;
故答案为:2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O;
(3)由反应的离子方程式可知H2SO3被氧化生成的氧化产物为H2SO4,属于生成物;
故答案为:BC;
(4)已知反应的离子方程式为:2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O,Mn元素的化合价从+7价降低到+2价得到5个电子,则2molMnO4-转移电子数为10N A电子,当有20mL 0.1mol/L的高锰酸钾参加反应时,高锰酸钾的物质的量为0.002mol,转移的电子数为0.01NA;
故答案为:0.01NA;
(5)高锰酸钾为紫色溶液,反应生成为无色的MnSO4,用标准KMnO4溶液滴定H2SO3时,溶液由无色变为紫红色,且半分钟内不变色说明达到滴定终点;
故答案为:溶液由无色变为紫红色,且半分钟内不变色;
(6)已知反应的离子方程式为:2MnO4-+5H2SO3=2Mn2++5SO42-+4H++3H2O,反应物H2SO3是弱电解质,部分电离,生成的H2SO4是强电解质,全部电离,反应后生成硫酸,溶液中氢离子浓度增大,所以溶液的pH减小,则(a)图象符合,溶液中离子浓度越大,溶液导电性越强,所以导电性增强,即(c)图象符合;
故答案为:(a)(c).
点评 本题考查了硫的化合物的性质、氧化还原反应的应用和酸碱中和滴定,题目难度中等,注意把握滴定原理以及实验终点的判断,为该题的易错点.

 期末集结号系列答案
期末集结号系列答案| A. | 鉴别苯与甲苯可用酸性高锰酸钾溶液 | |
| B. | 油脂和蛋白质都是能发生水解反应的高分子化合物 | |
| C. | 有机物CH3CH=CHCl存在顺反异构现象 | |
| D. | 有机物 中所有原子可能处于同一平面 中所有原子可能处于同一平面 |
| A. | KNO3是还原剂,其中N元素被氧化 | |
| B. | 生成物中的N2是氧化产物,K2O是还原产物 | |
| C. | 若有65 g NaN3参加反应,则被氧化N的物质的量为3.2mol | |
| D. | 每转移1 mole-,可生成标准状况下N2的体积为35.84L |
| A. | 两种盐溶液混合就一定能生成两种新盐 | |
| B. | 金属和酸都能发生置换反应生成氢气 | |
| C. | 金属与盐溶液反应一定得到金属和新盐 | |
| D. | 碱性氧化物加入水后不一定生成碱 |