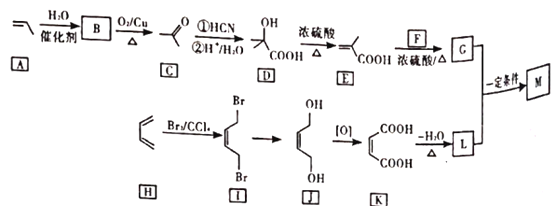
题目内容
【题目】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的价电子轨道表示式为___________;第二周期的元素中,第一电离能介于B和N之间的元素有___________种。
(2)雌黄的分子式为As2S3,其分子结构如图所示:![]() As原子的杂化类型为___________。
As原子的杂化类型为___________。
(3)①向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。SO42-的空间构型为___________;[Cu(NH3)4]SO4·H2O固体中含有的化学键有___________(填标号)。
A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行___________实验。
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是___________。
(4)大π键可用![]() 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]() 。N2O分子中的大π键表示为_________________。
。N2O分子中的大π键表示为_________________。
(5)立方氮化硼晶胞如图,其密度为ρg/cm3,氮化硼的摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,硼原子的半径为r cm,则硼原子的空间占有率为____________________(用含有ρ、M、NA、r的代数式表示)。

【答案】![]() 3 sp3 正四面体形 ABE X射线衍射 F的电负性比N大,N-F成键电子对偏向F,导致NF3中N原子对其孤电子对的吸引能力增强,难以形成配位键
3 sp3 正四面体形 ABE X射线衍射 F的电负性比N大,N-F成键电子对偏向F,导致NF3中N原子对其孤电子对的吸引能力增强,难以形成配位键 ![]()
![]()
【解析】
(1)N是7号元素,最外层有5个电子,即价电子是5,基态氮原子的价电子轨道表示式为![]() ;一般情况下,同周期元素随原子序数增大,元素第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素的,第二周期第一电离能介于B和N之间的元素有Be、C、O 3种;
;一般情况下,同周期元素随原子序数增大,元素第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素的,第二周期第一电离能介于B和N之间的元素有Be、C、O 3种;
(2)雌黄的分子式为As2S3,在其分子结构每个As与3个S原子形成3个σ键、还含有1对孤电子对,杂化轨道数目为3+1=4,As杂化方式为sp3杂化;
(3)①SO42-的价电子对数=![]() ,形成四条杂化轨道,中心原子S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;
,形成四条杂化轨道,中心原子S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;
[Cu(NH3)4]SO4·H2O固体中內界离子遇外界离子间通过离子键结合;在配位体NH3、H2O分子内及SO42-中含有共价键;NH3与中心离子Cu2+间通过配位键结合,所以该晶体中含有的化学键有离子键、共价键、配位键,序号为ABE。
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行X射线衍射实验;
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,这是由于F的电负性比N大,N-F成键电子对偏向F,导致NF3中N原子对其孤电子对的吸引能力增强,难以形成配位键;
(4)大π键可用![]() 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]() 。N2O(与二氧化碳是等电子体)分子中的大π键表示为
。N2O(与二氧化碳是等电子体)分子中的大π键表示为![]() ;
;
(5)晶胞中B原子数目=4、N原子数目=8×![]() +6
+6![]() =4,二者原子数目之比为1:1,B原子配位数为4,则N原子配位数也是4。晶胞质量=
=4,二者原子数目之比为1:1,B原子配位数为4,则N原子配位数也是4。晶胞质量=![]() ,晶胞体积V==
,晶胞体积V==![]() =
=![]() cm3;晶胞内B原子的总体积=4×
cm3;晶胞内B原子的总体积=4×![]() cm3,所以硼原子的空间利用率=
cm3,所以硼原子的空间利用率=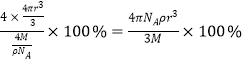 。
。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】在100℃时,将0.2molN2O4(g)充入2L的恒容密闭容器中,间隔一定时间后对该容器内各物质的物质的量进行测定,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
N(N2O4)/mol | 0.20 | n1 | 0.10 | n3 | n4 |
N(NO2)/mol | 0.00 | 0.12 | n2 | 0.24 | 0.24 |
(1)该反应的平衡常数表达式为___________________________,由表中数据分析可得,n1=____mol,n3=________________mol;
(2)在上述条件下,从0到40s内NO2的平均反应速率为___________________;
(3)该反应达到化学平衡后,下列改变可使N2O4浓度增大的是_____(填序号);
A.增大容器的容积 B.向容器中充入一定量的NO2
C.向容器中再充入一定量的N2O4 D.向容器中充入一定量的He(g)
(4)在下图中画出此反应中N2O4的浓度随时间变化的曲线_________。