题目内容
【题目】常温下,有关下列溶液的说法不正确的是
A. 20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:
c(CH3COO-)c(Cl-)c(CH3COOH)c(H+)
B. 0.1mol/L Na2C2O4溶液与 0.1mol/L HCl 溶液等体积混合,所得溶液中:
2c(C2O42-)+c(HC2O4-)+ c(OH-)= c(Na+)+ c(H+)
C. 含等物质的量的NaHC2O4和Na2C2O4的溶液中:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
D. 将amol/L氨水与0.01mol/L 盐酸等体积混合,若反应完全时溶液中 c(NH4+)=c(Cl-),则NH3·H2O的电离常数![]()
【答案】B
【解析】20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合,所得溶液为等浓度的醋酸钠和醋酸、氯化钠的混合液,溶液呈酸性,说明醋酸电离大于醋酸钠水解,c(CH3COO-)c(Cl-)c(CH3COOH)c(H+),故A正确;0.1mol/L Na2C2O4溶液与 0.1mol/L HCl 溶液等体积混合,所得溶液中,根据电荷守恒2c(C2O42-)+c(HC2O4-)+ c(OH-)+ c(Cl-)= c(Na+)+ c(H+)
,故B错误;含等物质的量的NaHC2O4和Na2C2O4的溶液中,根据物料守恒:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故C正确;将amol/L氨水与0.01mol/L 盐酸等体积混合,根据电荷守恒c(H+)+ c(NH4+)=c(OH-)+ c(Cl-),若反应完全时溶液中 c(NH4+)=c(Cl-)=0.005 mol/L,则溶液呈中性,根据物料守恒c(NH3·H2O)+ c(NH4+)=a/2 mol/L,则NH3·H2O的电离常数 ,故D正确。
,故D正确。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体。教师结合小明已有知识设计了下图所示装置进行实验。
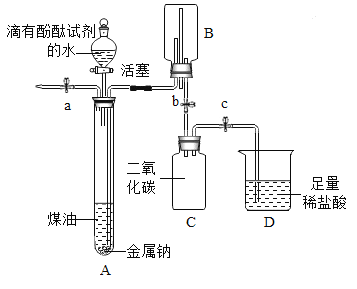
【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL。
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是__________。
(2)实验过程
操作 | 现象及解释 | |
① | 打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞。 | 液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中。由此可知金属钠的物理性质_______(写出一点即可)。 |
② | 打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b。 | 反应的化学方程式为_____________. |
③ | 打开止水夹c。 | _______,溶液红色消失。 反应的化学方程式为_________。 |
④ | 将燃着的木条伸到导管尖嘴处,打开止水夹a; 在火焰上方罩一个干冷的烧杯。 | 气体燃烧,产生淡蓝色火焰 烧杯内壁有无色液滴生成,A中气体为氢气。 |
(3)反思分析
金属钠与水反应的化学方程式为_____________;
反应结束,C中溶液的溶质是_________(指示剂除外,写出所有可能)。

