题目内容
【题目】工业合成氨N2+3H2![]() 2NH3反应过程中的能量变化如图所示,据图回答下列问题:
2NH3反应过程中的能量变化如图所示,据图回答下列问题:

(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低________________,理由是___________________________________________。
(2)该反应的平衡常数表达式为:K=___________________,当浓度商Qc___K(填“<”、“>”或“=”)时,反应向右进行。
(3)450 ℃时该反应的平衡常数___500 ℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有___(填字母序号)。
a.高温高压
b.加入催化剂
c.增加N2的浓度
d.增加H2的浓度
e.分离出NH3
【答案】降低 催化剂能降低反应的活化能 K=c2(NH3)/[c(N2)×c3(H2)] < > ce
【解析】
(1)使用催化剂降低了活化分子的活化能,增加了单位体积内活化分子百分数,加快反应速率,B点降低,原因催化剂降低了反应的活化能;
(2)平衡常数:一定温度下,达到化学平衡生成物浓度的幂之积与反应物浓度的幂之积比值,即此反应的平衡常数表达式:K=c2(NH3)/[c(N2)×c3(H2)],反应向右进行,即向正反应方向进行,Qc<K;
(3)根据能量变化图,此反应是放热反应,根据勒夏特列原理,升高温,平衡向吸热反应方向进行,450℃时该反应的平衡常数大于500℃时的;
(4)要提高H2的转化率,平衡向正反应方向进行,且氢气的总量不变,
a、根据勒夏特列原理增大压强平衡向体积减小的方向移动,即向正反应方向进行,但是此反应是吸热反应,高温平衡向逆反应方向进行,不能提高氢气的转化率,错误;
b、催化剂只影响化学反应速率,对化学平衡无影响,错误;
c、增加N2的浓度,增加了反应物的浓度,化学平衡正向移动,且没改变氢气的总量,提高了氢气的转化率,正确;
d、增加氢气的浓度,虽然平衡右移,但是氢气的总量增加,转化率反而降低,错误;
e、分离出氨气,减少了生成物的浓度,平衡向右移动,且氢气的总量不变,转化率增大,正确,综上所述ce选项符合题意。

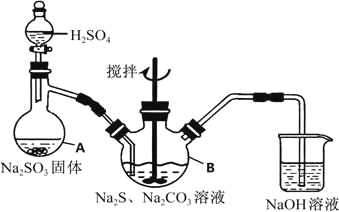
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向 | 得到澄清溶液 |
|
B | 将 | 溶液变红 | 稀硫酸能氧化 |
C | 室温下,用pH试纸分别测定浓度为 | pH试纸都变成碱色 | 可以用pH试纸的颜色与标准比色卡比较,从而判断HClO和 |
D | 向少量 | 开始有白色沉淀生成,后有黑色沉淀生成 |
|
A.AB.BC.CD.D