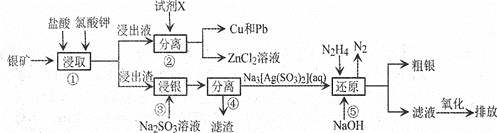
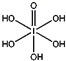
题目内容
【题目】A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,A、B、F三者原子序数之和为25,且知B、F同主族,![]() 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成![]() 氢气
氢气![]() 标准状况下
标准状况下![]() ,
,![]() 和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30。试判断并回答下列问题:
![]() 该元素在周期表中的位置__________ .
该元素在周期表中的位置__________ .
![]() 由F、G二种元素形成化合物
由F、G二种元素形成化合物![]() 的电子式______,含有化学键的类别为___________.
的电子式______,含有化学键的类别为___________.
![]() 、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为________
、C、F形成的最简单气态氢化物沸点由低到高的顺序依次为________![]() 用化学式表示
用化学式表示![]()
![]() 由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式__________
由A、B、D、F四种元素可以组成两种盐,写出这两种盐反应的离子方程式__________
![]() 在碱性条件下,G的单质可与
在碱性条件下,G的单质可与![]() 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐![]() ,该反应的离子方程式是_______.
,该反应的离子方程式是_______.
![]() 熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气
熔融盐燃料电池用熔融的碳酸盐作为电解质,负极充入燃料气![]() ,用空气与
,用空气与![]() 的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入
的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。写出充入![]() 的一极发生反应的电极反应式______。
的一极发生反应的电极反应式______。
![]() 利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,
利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,

Ⅰ![]() 甲槽电解的是
甲槽电解的是![]() 一定浓度的NaCl与
一定浓度的NaCl与![]() 的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示
的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示![]() 气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计
气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计![]() 。
。![]() 的物质的量浓度为________
的物质的量浓度为________![]() 。
。
Ⅱ![]() 乙槽为
乙槽为![]() 溶液,通电一段时间,当C极析出
溶液,通电一段时间,当C极析出![]() 物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入________
物质时停止通电,若使乙槽内的溶液完全复原,可向乙槽中加入________![]() 填字母
填字母![]() 。
。
A ![]()
![]()
![]()
![]()
![]() 若通电一段时间后,向所得的乙槽溶液中加入
若通电一段时间后,向所得的乙槽溶液中加入![]() 的
的![]() 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________。
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________。
【答案】第四周期第ⅧA族;  极性共价键、非极性共价键
极性共价键、非极性共价键 ![]() 、HF、
、HF、![]()
![]() ;
; ![]()
![]()
![]()
![]()
![]()
【解析】
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,![]() 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成![]() 氢气
氢气![]() 标准状况下
标准状况下![]() ,则E为Al,G为Cl,
,则E为Al,G为Cl,![]() 和E的离子具有相同的电子层结构,则D为Na,工业上用电解氧化铝方法冶炼铝单质,所以B为O,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,C的原子序数大于氧、小于钠,故C为氟,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30,则H为Fe。
和E的离子具有相同的电子层结构,则D为Na,工业上用电解氧化铝方法冶炼铝单质,所以B为O,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,C的原子序数大于氧、小于钠,故C为氟,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30,则H为Fe。
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,![]() 与G的气态氢化物的水溶液反应生成
与G的气态氢化物的水溶液反应生成![]() 氢气
氢气![]() 标准状况下
标准状况下![]() ,则E为Al,G为Cl,
,则E为Al,G为Cl,![]() 和E的离子具有相同的电子层结构,则D为Na,工业上用电解氧化铝方法冶炼铝单质,所以B为O,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,C的原子序数大于氧、小于钠,故C为氟,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30,则H为Fe。
和E的离子具有相同的电子层结构,则D为Na,工业上用电解氧化铝方法冶炼铝单质,所以B为O,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,C的原子序数大于氧、小于钠,故C为氟,H元素常温下遇浓硫酸钝化,其一种核素质量数56,中子数30,则H为Fe。
![]() 是Fe,在元素周期表中的位置是第四周期第ⅧA族,故答案为:第四周期第ⅧA族;;
是Fe,在元素周期表中的位置是第四周期第ⅧA族,故答案为:第四周期第ⅧA族;;
![]() 由F、G二种元素形成化合物
由F、G二种元素形成化合物![]() 的电子式为
的电子式为 ;含有化学键的类别为极性共价键、非极性共价键;故答案为:
;含有化学键的类别为极性共价键、非极性共价键;故答案为: ;极性共价键、非极性共价键;
;极性共价键、非极性共价键;
![]() 、C、F形成的最简单气态氢化物分别是
、C、F形成的最简单气态氢化物分别是![]() 、HF、
、HF、![]() ;HF、
;HF、![]() 常温下为气体,HF分子之间存在氢键,沸点高于
常温下为气体,HF分子之间存在氢键,沸点高于![]() ,水常温下为液态,沸点最高,故沸点由低到高的顺序是
,水常温下为液态,沸点最高,故沸点由低到高的顺序是![]() 、HF、
、HF、![]() ;故答案为:
;故答案为:![]() 、HF、
、HF、![]() ;
;
![]() ①四种元素要形成酸式盐,阳离子只能为
①四种元素要形成酸式盐,阳离子只能为![]() ,阴离子只能为亚硫酸氢根或硫酸氢根,写离子方程式时亚硫酸氢钠拆分为钠离子和亚硫酸氢根,硫酸氢钠拆分为钠离子、氢离子和硫酸根,等式两端抵消掉某些离子后,离子方程式为:
,阴离子只能为亚硫酸氢根或硫酸氢根,写离子方程式时亚硫酸氢钠拆分为钠离子和亚硫酸氢根,硫酸氢钠拆分为钠离子、氢离子和硫酸根,等式两端抵消掉某些离子后,离子方程式为:![]() ;
;
②在碱性条件下,G的单质![]() 可与
可与![]() 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐![]() ,该反应的离子方程式是
,该反应的离子方程式是![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 负极发生氧化反应,所以
负极发生氧化反应,所以![]() 的一极发生反应的电极反应式
的一极发生反应的电极反应式![]() ;故答案为:
;故答案为:![]() ;
;
![]() Ⅰ
Ⅰ![]() 电解200mL一定浓度的NaCl与
电解200mL一定浓度的NaCl与![]() 混合溶液,阳极发生
混合溶液,阳极发生![]() 、
、![]() ,阴极发生
,阴极发生![]() 、
、![]() ,结合图可知,a为阴极气体体积与时间的关系,b为阳极气体体积与时间的关系,由图可知,产生氯气为224mL,
,结合图可知,a为阴极气体体积与时间的关系,b为阳极气体体积与时间的关系,由图可知,产生氯气为224mL,![]() ,
,![]() 时生成氧气为112mL,
时生成氧气为112mL,![]() ,则共转移电子为
,则共转移电子为![]() ,根据电子守恒及
,根据电子守恒及![]() 可知,
可知,![]() ,所以
,所以![]() ;故答案为:0.1;
;故答案为:0.1;
Ⅱ![]() 根据电极方程式即阳极发生
根据电极方程式即阳极发生![]() ,阴极发生
,阴极发生![]() 。
。
电解过程中损失的元素有铜和氧,A、多加了H元素,错误;B、能够补充铜和氧元素,正确;C、![]() 与硫酸反应放出二氧化碳,相当于加入了氧化铜,正确;
与硫酸反应放出二氧化碳,相当于加入了氧化铜,正确;![]() 多加了H元素,错误;故答案为:BC;
多加了H元素,错误;故答案为:BC;
![]() 加入
加入![]() 相当于加入
相当于加入![]() 和
和![]() ,则电解过程中共转移电子数为
,则电解过程中共转移电子数为![]()
![]() ,数目为
,数目为![]() ,故答案为:
,故答案为:![]() 。
。

 特高级教师点拨系列答案
特高级教师点拨系列答案