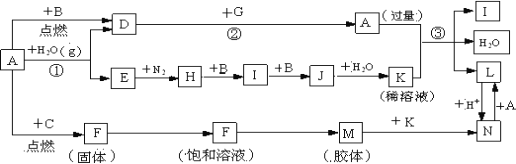
题目内容
【题目】高温下,某反应达到平衡,平衡常数K= ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.升高温度,逆反应速率减小
B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小
D.该反应的化学方程式为CO+H2O ![]() CO2+H2
CO2+H2
【答案】B
【解析】解:平衡常数k= ![]() ,所以该反应化学方程式应为CO2+H2
,所以该反应化学方程式应为CO2+H2![]() CO+H2O.
CO+H2O.
A、温度升高,正逆反应都增大,故A错误;
B、恒容时,温度升高,H2浓度减小,平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即该反应的焓变为正值,故B正确;
C、恒温恒容下,增大压强,如果是加入稀有气体的话,各物质浓度没有变,所以平衡不移动,此时各物质的浓度不会变化,若增大二氧化碳浓度,H2浓度一定减小,若中等CO或水的浓度,H2浓度一定增大,故C错误;
D、平衡常数k= ![]() ,所以该反应化学方程式应为CO2+H2
,所以该反应化学方程式应为CO2+H2![]() CO+H2O,故D错误.
CO+H2O,故D错误.
故选B.
平衡常数指可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,平衡常数k= ![]() ,所以该反应化学方程式应为CO2+H2
,所以该反应化学方程式应为CO2+H2![]() CO+H2O.
CO+H2O.
A、温度升高,正逆反应都增大;
B、恒容时,温度升高,H2浓度减小,平衡向正反应移动,升高温度平衡向吸热反应移动;
C、恒温恒容下,增大压强,分析引起压强增大的可能原因进行判断,如是加入稀有气体的话,各物质浓度没有变,所以平衡不移动,此时各物质的浓度不会变化;
D、根据平衡常数表达式书写反应方程式.

【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: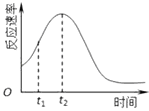
①;② .
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.