题目内容
【题目】下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
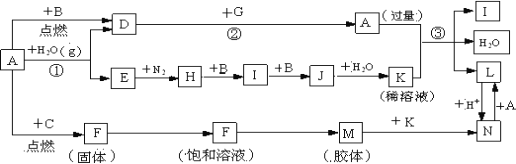
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式____________________。实验室引发该反应的操作___________。
(3)反应③离子方程式__________________________。
(4)H→I的化学方程式_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
【答案】 第四周期 第VIII族 8Al+ 3Fe3O4![]() 4Al2O3 + 9Fe 在铝热剂表面放一层氯酸钾,插一根镁条,点燃镁条 3Fe + 8H+ + 2NO3— = 3Fe2+ + 2NO↑+ 4H2O
4Al2O3 + 9Fe 在铝热剂表面放一层氯酸钾,插一根镁条,点燃镁条 3Fe + 8H+ + 2NO3— = 3Fe2+ + 2NO↑+ 4H2O ![]() O2 0.045
O2 0.045
【解析】A为26号元素,则A为Fe;C为黄绿色气体,则C为Cl2;M为红褐色胶体,则M为Fe(OH)3;A(Fe)与C(Cl2)点燃得到F,则F为FeCl3;A(Fe)与H2O(g)反应生成D和E,A(Fe)与气体B反应也得到D,则D为Fe3O4,E为H2,B为O2;E(H2)+N2→H,则H为NH3;H+B→I,I+B→J,J+H2O→K,则J为NO2;I为NO;K为HNO3;过量的A(Fe)和K(HNO3)反应生成硝酸亚铁、NO、水,则L为Fe(NO3)2;N+A(Fe)→L,则N为Fe(NO3)3;D+G→A,即Fe3O4+G→Fe,又G为常见金属,则G为Al。
(1)A为Fe,原子序数是26,在周期表中的位置为:第四周期 第ⅤⅢ族;
(2)“D+G→A”即“Fe3O4+Al→Fe”,反应的化学方程式:8Al+3Fe3O4![]() 4Al2O3+9Fe;该反应为铝热反应,实验室中引发铝热反应的操作方法是:在铝热剂表面放一层氯酸钾,插一根镁条,点燃镁条。
4Al2O3+9Fe;该反应为铝热反应,实验室中引发铝热反应的操作方法是:在铝热剂表面放一层氯酸钾,插一根镁条,点燃镁条。
(3)反应③为过量的Fe与稀硝酸反应,离子方程式:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(4)“H→I”为NH3与O2反应生成NO和H2O,反应方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(5)将一试管气体J(NO2)倒立于水槽中,若使水充满整个试管,则应向试管中通入一定量氧气,发生反应:4NO2+O2+2H2O=4HNO3。设原试管中NO2体积为VL,n(HNO3)=n(NO2)= ![]() ;c(HNO3)=
;c(HNO3)= ![]() =
= ![]() =0.045mol/L。故答案为:O2;0.045mol/L。
=0.045mol/L。故答案为:O2;0.045mol/L。

【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )

M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D



