题目内容
【题目】电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2molL﹣1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( ) 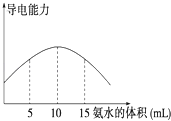
A.0.5%
B.1.5%
C.0.1%
D.1%
【答案】D
【解析】解:根据图象分析,当氨水的体积为10ml时导电性最强,说明刚好与醋酸完全反应,所以醋酸的浓度为: ![]() =0.1molL﹣1,再根据pH=3的 CH3COOH溶液,则氢离子浓度为:10﹣3molL﹣1,所以CH3COOH的电离度为
=0.1molL﹣1,再根据pH=3的 CH3COOH溶液,则氢离子浓度为:10﹣3molL﹣1,所以CH3COOH的电离度为 ![]() ×100%=1%,故选:D;
×100%=1%,故选:D;
根据图象分析,当氨水的体积为10ml时导电性最强,说明刚好与醋酸完全反应,所以醋酸的浓度为: ![]() =0.1molL﹣1,再根据pH=3的 CH3COOH溶液,则氢离子浓度为:10﹣3molL﹣1,所以CH3COOH的电离度为=(已电离的电解质的物质的量/原来总的物质的量)×100%进行计算;
=0.1molL﹣1,再根据pH=3的 CH3COOH溶液,则氢离子浓度为:10﹣3molL﹣1,所以CH3COOH的电离度为=(已电离的电解质的物质的量/原来总的物质的量)×100%进行计算;

练习册系列答案
相关题目
【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )

M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D
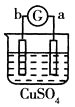
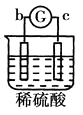
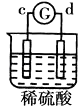
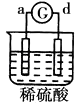
【题目】有a、b、c、d四个金属电极,G为电流计,有关的反应装置及部分反应现象记录如下:
实验 |
|
|
|
|
部分实 | a极质量减小 | 溶液中的SO42﹣﹣向b极移动 | d极溶解c极 | 电子从d极 |
由此可判断这四种金属的活动性顺序是( )
A.d>a>b>c
B.a>b>c>d
C.b>c>d>a
D.a>b>d>c