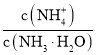题目内容
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次递增。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D四种元素第一电离能最大的是_______________。
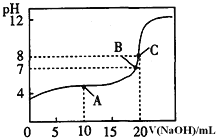
(2)B的氯化物的熔点比D的氯化物的熔点__________(填“高”或“低”),理由是_________________________。
(3)A的简单氢化物分子中的中心原子采取_______杂化,E的低价氧化物分子的立体构型是_______________。用KMnO4酸性溶液吸收该氧化物时,该反应的离子方程式为:_____________________________________________________________。
(4)F的核外电子排布式是___________,F的高价离子与A的简单氢化物形成的配离子的化学式为____________。
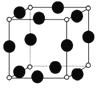
(5)A、F形成某种化合物的晶胞结构如图所示(其中A显-3价),若晶胞边长为a pm,阿伏伽德罗常数为NA,则该晶体的密度计算式为ρ=________________ g/cm3。
【答案】N 高 NaCl为离子晶体,而SiCl4为分子晶体 sp3 V形(或角型) 5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+ 1s22s22p63s23p63d104s1(或[Ar]3d104s1) [Cu(NH3)4]2+ ![]()
【解析】
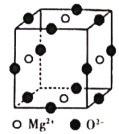
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F,C元素是地壳中含量最高的金属元素,则C为Al元素;A原子核外有三个未成对电子,原子序数小于Al元素,其电子排布式为1s22s22p3,则A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,则E为S元素;D单质的晶体类型在同周期的单质中没有相同的,D处于第三周期,故D为Si元素;化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,则B为Na元素;F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为1s22s22p63s23p63d104s1,故F为Cu元素,以此解答该题。
由上述分析可知,A为N,B为Na,C为Al,D为Si,E为S,F为Cu;
(1)在元素周期表中,同一周期元素的第一电离能从左到右呈增大趋势,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Na<Al<Si<N,
故答案:N;
(2)因NaCl为离子晶体,而SiCl4为分子晶体,离子晶体的熔沸点远大于分子晶体的熔沸点,故NaCl晶体熔点高,
故答案为:高;NaCl为离子晶体,而SiCl4为分子晶体;
(3)A为N元素,对应的氢化物为氨气,含有3个σ键,且有1个孤电子对,则为sp3杂化;E的低价氧化物为SO2,S原子孤电子对数为![]() =1,价层电子对数为2+1=3,则为V形结构;KMnO4酸性溶液吸收SO2气体时,MnO4-被还原为Mn2+,SO2被氧化为SO42-,该反应的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+,
=1,价层电子对数为2+1=3,则为V形结构;KMnO4酸性溶液吸收SO2气体时,MnO4-被还原为Mn2+,SO2被氧化为SO42-,该反应的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+,
故答案为:sp3;V形(或角型);5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+;
(4)F为Cu元素,其核外电子排布式为:1s22s22p63s23p63d104s1(或[Ar]3d104s1),铜离子与氨气可以配位键形成配离子,其化学式为[Cu(NH3)4]2+,
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);[Cu(NH3)4]2+;
(5)F为Cu,A为N,且N为-3价,由晶胞结构图可知,N原子在顶点,则N原子数为8×![]() =1,Cu原子在棱心,则Cu原子数为12×
=1,Cu原子在棱心,则Cu原子数为12×![]() =3,所以化学式为Cu3N,若晶胞边长为apm,则晶胞体积为a3pm3,阿伏伽德罗常数为NA,晶胞的质量为
=3,所以化学式为Cu3N,若晶胞边长为apm,则晶胞体积为a3pm3,阿伏伽德罗常数为NA,晶胞的质量为![]() g,则该晶体的密度计算式为ρ=
g,则该晶体的密度计算式为ρ= =
=![]() g/cm3,
g/cm3,
故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案