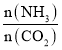题目内容
【题目】现有常温下浓度均为![]() 的下列5种溶液:
的下列5种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是________________,其中由水电离的
这5种溶液pH由大到小的顺序是________________,其中由水电离的![]() 浓度最小的是______。
浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是________________________________________________________,
中各离子浓度由大到小的顺序是________________________________________________________,![]() 的水解平衡常数
的水解平衡常数![]() _________________。
_________________。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时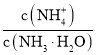 的值__________
的值__________![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是____________
的溶液分别蒸干并灼烧,最终可得原溶质的是____________![]() 填序号
填序号![]() 。
。
![]() 一定量的稀
一定量的稀![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
![]() 常温下,向
常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为_____
的溶液为_____![]()
![]() 已知常温下
已知常温下![]() 。
。
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈__________________性,溶液中
的醋酸等体积混合后溶液呈__________________性,溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 常温下,用
常温下,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图.
某一元酸HA溶液所得滴定曲线如图.
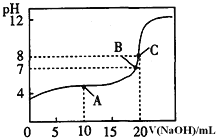
![]() A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() 点的离子浓度大小关系是 ________________________________ .
点的离子浓度大小关系是 ________________________________ .
【答案】![]()
![]()
![]()
![]() 减小 大于
减小 大于 ![]()
![]() 有红褐色沉淀生成,有气泡冒出
有红褐色沉淀生成,有气泡冒出 ![]()
![]() 碱
碱 ![]() 酸
酸 ![]()
![]()
![]()
【解析】
![]() 相同浓度的溶液中,
相同浓度的溶液中,![]() 溶液为酸性溶液,
溶液为酸性溶液,![]() 溶液中碳酸根离子部分水解,溶液显示弱碱性,
溶液中碳酸根离子部分水解,溶液显示弱碱性,![]() 溶液中铵离子部分水解,溶液显示弱酸性,
溶液中铵离子部分水解,溶液显示弱酸性,![]() 溶液为强碱溶液,
溶液为强碱溶液,![]() 溶液中铵离子部分水解,溶液显示弱酸性,但铵离子浓度大于
溶液中铵离子部分水解,溶液显示弱酸性,但铵离子浓度大于![]() 溶液,即
溶液,即![]() 溶液酸性大于
溶液酸性大于![]() 溶液,所以这5种溶液pH由大到小的顺序为:
溶液,所以这5种溶液pH由大到小的顺序为:![]() ;
;
![]() 为含有弱酸根或者弱碱根离子的盐溶液,促进了水的电离,而
为含有弱酸根或者弱碱根离子的盐溶液,促进了水的电离,而![]() 分别为酸和碱溶液,抑制了水的电离,其中
分别为酸和碱溶液,抑制了水的电离,其中![]() 电离的氢离子浓度大于
电离的氢离子浓度大于![]() 电离的氢氧根离子,所以
电离的氢氧根离子,所以![]() 中水的电离程度最小;
中水的电离程度最小;
![]() 碳酸氢钠溶液中,碳酸氢根离子水解使溶液呈碱性,说明碳酸氢根的水解程度大于电离程度,同时水存在电离平衡,所以碳酸氢钠溶液中离子浓度大小关系为:
碳酸氢钠溶液中,碳酸氢根离子水解使溶液呈碱性,说明碳酸氢根的水解程度大于电离程度,同时水存在电离平衡,所以碳酸氢钠溶液中离子浓度大小关系为:![]() ;碳酸氢钠溶液中的水解平衡常数为:
;碳酸氢钠溶液中的水解平衡常数为:![]() ;
;
故答案为![]() ,
, ![]() ;
;
![]() 一水合氨的电离平衡常数
一水合氨的电离平衡常数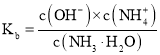 ,所以
,所以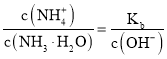 ,通入氨气后,溶液中氢氧根离子浓度增大,该比值减小;
,通入氨气后,溶液中氢氧根离子浓度增大,该比值减小;
![]() 若氯化铵与氢氧化钠溶液等浓度等体积混合,二者恰好反应生成氯化钠和氨水,溶液显示碱性,若要使溶液显示中性,则氯化铵的体积应该大些或者氢氧化钠溶液体积小些,即氯化铵溶液体积大于氢氧化钠溶液体积,
若氯化铵与氢氧化钠溶液等浓度等体积混合,二者恰好反应生成氯化钠和氨水,溶液显示碱性,若要使溶液显示中性,则氯化铵的体积应该大些或者氢氧化钠溶液体积小些,即氯化铵溶液体积大于氢氧化钠溶液体积,
![]() 和
和![]() 对热不稳定,受热易分解,NaOH受热不分解,所以灼烧可得原溶质的是NaOH溶液;
对热不稳定,受热易分解,NaOH受热不分解,所以灼烧可得原溶质的是NaOH溶液;
![]() 加醋酸钠固体,生成醋酸为弱电解质,溶液氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故选A;
加醋酸钠固体,生成醋酸为弱电解质,溶液氢离子浓度降低,反应速率减小,但生成氢气的总量不变,故选A;
B.加![]() 固体,氯化铵水解呈酸性,生成氢气的总量增大,故不选B;
固体,氯化铵水解呈酸性,生成氢气的总量增大,故不选B;
C.加![]() 溶液,氢离子总量不变,但生成的硝酸有强氧化性,和Zn反应生成NO,使
溶液,氢离子总量不变,但生成的硝酸有强氧化性,和Zn反应生成NO,使![]() 的总量减小,故不选C;
的总量减小,故不选C;
D.加氨水,消耗酸,生成氢气总量减小,故不选D;
E.加![]() 溶液,氢离子总量不变,溶液总体积增大,氢离子浓度降低,反应速率减小,故选E;
溶液,氢离子总量不变,溶液总体积增大,氢离子浓度降低,反应速率减小,故选E;
故选AE;
![]() 是强酸弱碱盐,
是强酸弱碱盐,![]() 是强碱弱酸盐,
是强碱弱酸盐,![]() 和
和![]() 相互促进水解生成氢氧化铁沉淀、二氧化碳气体和氯化钠,所以所以现象为:有红褐色沉淀生成,有气泡冒出,反应的离子方程式为
相互促进水解生成氢氧化铁沉淀、二氧化碳气体和氯化钠,所以所以现象为:有红褐色沉淀生成,有气泡冒出,反应的离子方程式为![]() ;
;![]() 的溶液中
的溶液中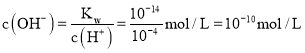 ,
,![]() ,所以溶液中
,所以溶液中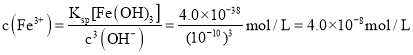 ,
,
故答案为有红褐色沉淀生成,有气泡冒出,![]() ,
,![]() ;
;
![]() 等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,
等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,![]() ,
,![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,醋酸根离子浓度大于钠离子浓度,
的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,醋酸根离子浓度大于钠离子浓度,![]() ,
,
故答案为:碱,![]() ,酸,
,酸,![]() ;
;
![]() 0.1000mol/L的HA的pH>1,所以HA为弱酸,C点恰好反应生成盐,离子浓度最大,导电能力最强;A点时,溶液中的溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于
0.1000mol/L的HA的pH>1,所以HA为弱酸,C点恰好反应生成盐,离子浓度最大,导电能力最强;A点时,溶液中的溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于![]() 的水解程度,所以溶液中离子浓度大小的关系为
的水解程度,所以溶液中离子浓度大小的关系为![]() ,
,
故答案为:![]() ,
,![]() 。
。