题目内容
【题目】某工厂的工业废水中含有大量的FeSO4和CuSO4,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收FeSO4和金属Cu。请根据以下流程图,回答相关问题:
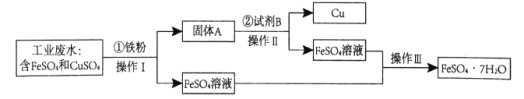
(1)操作Ⅰ和操作Ⅱ分离固体和溶液的方法是_____________。
(2)为了将CuSO4完全转化,步骤①加入的铁粉应_______(选填“过量”或“少量”),其对应的化学方程式为___________。
(3)固体A的成分是铁和__________(填名称)。
(4)步骤②加入试剂B的稀溶液,B的化学式为_________ ,该物质在该反应中作_______剂(选填“氧化”或“还原”)。
(5)取1~2mlFeSO4溶液于试管中,滴加几滴NaOH溶液,生成的白色沉淀迅速变为灰绿色,最后变成_______________色。
(6)另取1~2ml FeSO4溶液于试管中,滴加几滴氯水,该反应的离子方程式为_______,向反应后的溶液中再滴加几滴__________溶液,溶液变为血红色。
【答案】过滤 过量 ![]() 铜单质 H2SO4 氧化 红褐色
铜单质 H2SO4 氧化 红褐色 ![]() KSCN
KSCN
【解析】
(1)分离固体和溶液的操作即过滤;
(2)为了保证CuSO4反应彻底,就需要加入过量的Fe粉;Fe与CuSO4溶液发生置换反应,方程式为:![]() ;
;
(3)固体A中除了未反应完的Fe,还有就是加入铁粉后置换出的Cu单质;
(4)分析步骤②可知,加入试剂B后Fe单质变成了FeSO4,而Cu单质不反应,所以B为稀硫酸;反应过程中,稀硫酸起氧化剂作用将Fe氧化;
(5)Fe2+与OH-反应生成白色的不稳定的Fe(OH)2,Fe(OH)2可以迅速被氧化发生反应:![]() ;最终生成红褐色的Fe(OH)3;
;最终生成红褐色的Fe(OH)3;
(6)FeSO4中加入氯水后发生氧化还原反应,离子方程式为:![]() ;由于反应后的溶液中有Fe3+,所以加入
;由于反应后的溶液中有Fe3+,所以加入![]() 后,溶液会出现血红色;
后,溶液会出现血红色;

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:
①CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
O2(g)=CO(g)+2H2(g) ΔH2=-35.4kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3=+165.0kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为__。
(2)从原料、能源利用的角度,分析以上三个反应,作为合成甲醇更适宜的是反应__(填序号)。
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
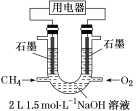
①0<V≤33.6L时,负极电极反应式为__。
②33.6L<V≤67.2L时,电池总反应方程式为__。
③V=44.8L时,溶液中离子浓度大小关系为__。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达到平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
Ⅰ | 1 | 4 | 0 | t1 | 放出热量:36.88 |
Ⅱ | 2 | 8 | 0 | t2 | 放出热量:Q |
①容器Ⅰ中,0~t1时间的平均反应速率v(H2)=__。
②下列叙述正确的是__(填字母)。
a.平衡时,两容器中H2的体积分数相等
b.容器Ⅱ中反应达到平衡状态时,Q>73.76
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:Ⅰ<Ⅱ
e.两容器达到平衡时所用时间:t1>t2
(5)如图是在反应器中将N2和H2按物质的量之比为1∶3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的体积分数随压强的变化曲线。

①曲线a对应的温度是__。
②图中M、N、Q点平衡常数K的大小关系是__。
③M点对应的H2转化率是__。