题目内容
12.A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图如图,据此填空:
(1)A的元素名称为硅.
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为O<S<P<Si.
(3)B和D最高价氧化物的水化物酸性由强到弱的顺序为H2SO4>H3PO4.
分析 A、B、C、D四种短周期元素,由A的结构示意图可知,x=2,故A为硅(Si)元素;C、B同主族,B、C可形成共价化合物BC3和BC2,可知B为S元素,C为O元素;A、B、D为相邻的同周期元素,故D为P元素,据此解答.
解答 解:A、B、C、D四种短周期元素,由A的结构示意图可知,x=2,故A为硅(Si)元素;C、B同主族,B、C可形成共价化合物BC3和BC2,可知B为S元素,C为O元素;A、B、D为相邻的同周期元素,故D为P元素.
(1)由上述分析可知,A为硅元素,故答案为:硅4;
(2)同周期自左而右原子半径减小,故原子半径Si>P>S,同主族自上而下原子半径增大,故原子半径S>O,所以原子半径半径由小到大的顺序为O<S<P<Si,故答案为:O<S<P<Si;
(3)非金属性S>P,最高价氧化物的水化物酸性:H2SO4>H3PO4,故答案为:H2SO4>H3PO4.
点评 本题考查位置结构性质的相互关系,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.铜锌原电池(如图)工作时,下列叙述正确的是( )
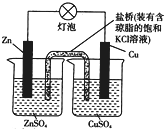

| A. | 正极反应为Zn-2e-═Zn2+ | B. | 电池反应为Zn2++Cu═Zn+Cu2+ | ||
| C. | 在外电路中,电子从负极流向正极 | D. | 盐桥中的K+移向ZnSO溶液 |
3.用氯化铝制取的纯净的硝酸铝的最佳方法是( )
| A. | 用氯化铝与纯硝酸反应 | |
| B. | 用氯化铝溶液和硝酸钡溶液反应 | |
| C. | 用氯化铝溶液与氢氧化钠反应,过滤得沉淀再加纯HNO3 | |
| D. | 用氯化铝溶液与氨水反应,过滤得沉淀再加纯HNO3 |
20.高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂.工业上可先制得高铁酸钠(离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO${\;}_{4}^{2-}$+3Cl-+5H2O,然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾.下列说法不正确的是( )
| A. | 高铁酸钾的还原产物易水解形成胶体,可使水中悬浮物凝聚沉降 | |
| B. | 工业上制备高铁酸钠时每生成1mol还原产物,转移3mol电子 | |
| C. | 高铁酸钾中Fe为+6价,具有强氧化性,能消毒杀菌 | |
| D. | 高铁酸钾能除去水中溶解的H2S等 |
7.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,28g C2H4和C3H6的混合物中含有2nA个C原子 | |
| B. | 1 mol Fe与足量稀HNO3反应,转移个2nA个电子 | |
| C. | 1L 0.1 mol/L NaHCO3溶液中含有0.1nA个HCO3- | |
| D. | 常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子 |
17.下列说法中正确的是( )
| A. | 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反 | |
| B. | 在一个多电子原子中,不可能有两个运动状态完全相同的电子 | |
| C. | 在一个多电子原子中,不可能有两个能量相同的电子 | |
| D. | 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 |
4.已知A、B、C、D、E是核电荷数依次增大的五种周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
| A. | A、E一定在不同周期 | |
| B. | D在第二周期 | |
| C. | A、D可能在同一主族 | |
| D. | C、D的单质可能化合形成离子化合物 |

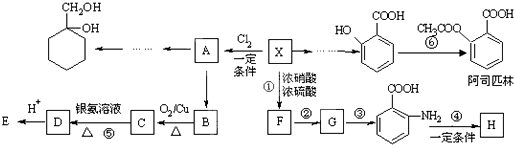
 Ⅱ
Ⅱ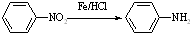 (苯胺,易被氧化)
(苯胺,易被氧化)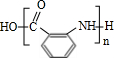 ;
;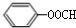 +2NaOH→
+2NaOH→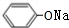 +HCOONa+H2O.
+HCOONa+H2O.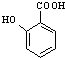 有多种同分异构体,其中含符合下列条件的共有2种.
有多种同分异构体,其中含符合下列条件的共有2种.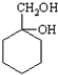 的过程.
的过程.