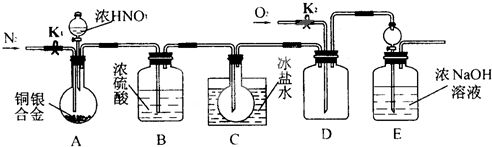
题目内容
14.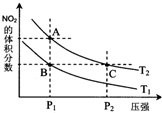 反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、B两点气体的颜色:A浅,B深 | |
| C. | A、C两点气体的平均相对分子质量:A>C | |
| D. | 由状态B到状态A,可以用加热的方法 |
分析 A、压强增大,化学反应速率会加快;
B、根据A、B两点压强相同,但温度不同,NO2为红棕色气体,由图象可知,A点NO2的体积分数大判断;
C、根据气体的平均相对分子质量M=$\frac{m}{n}$,结合A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小来回答;
D、压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大,a点NO2的体积分数大;
解答 解:A、C点的压强大于A点的压强,压强越大,化学反应速率越快,所以反应速率C>A,故A错误;
B、A、B两点压强相同,但温度不同,NO2为红棕色气体,由图象可知,A点NO2的体积分数大,则A、B两点气体的颜色:A深,B浅,故B错误;
C、由图象可知,A、C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,则平均相对分子质量大,即平均相对分子质量:A<C,故C错误;
D、升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,a点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故D正确;
故选D.
点评 本题考查学生影响化学平衡移动的因素:温度、压强等,注意图象题的分析方法,固定变量法是常用的处理方式,难度不大.

练习册系列答案
相关题目
2.25℃时,[NH4+]浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液,若其浓度分别为a、b、c(单位:mol/L),则下列判断正确的是( )
| A. | a=b=c | B. | c>a>b | C. | b>a>c | D. | a>c>b |
19.在无色透明的未知溶液中加入BaCl2溶液生成不溶于稀硝酸的白色沉淀,则未知溶液中可能大量存在( )
| A. | Ag+ | B. | SO42- | C. | CO32- | D. | OH- |

 对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET).国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口.以PX为主要原料生产PET的一种路线如图1:
对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET).国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口.以PX为主要原料生产PET的一种路线如图1: .(不用注明条件)
.(不用注明条件) .(不用注明条件)
.(不用注明条件) .
. 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色、纯净的Fe(OH)2沉淀,应用如图所示电解实验可制得白色、纯净的Fe(OH)2沉淀,两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色、纯净的Fe(OH)2沉淀,应用如图所示电解实验可制得白色、纯净的Fe(OH)2沉淀,两电极的材料分别为石墨和铁.