题目内容
【题目】如图是铁钉在某溶液中被腐蚀的实验(开始时试管中液面和试管外液面等高). 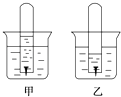
(1)甲、乙两图溶液中呈酸性的是(填“甲”或“乙”).
(2)甲图电极反应式是:正极 , 负极 .
(3)乙图中发生反应的离子方程式是 .
【答案】
(1)乙
(2)O2+2H2O+4e﹣═4OH﹣; Fe﹣2e﹣═Fe2+
(3)Fe+2H+═Fe2++H2↑
【解析】解:从两图中液面的高度可以看出,甲图试管内液面上升,说明气体体积减小,氧气被吸收,发生吸氧腐蚀,乙图试管内液面下降,说明气体体积增大,有氢气生成,发生析氢腐蚀,(1)由以上分析可知乙发生析氢腐蚀,溶液呈酸性,所以答案是:乙;(2)甲发生吸氧腐蚀,正极发生还原反应,电极方程式为O2+2H2O+4e﹣═4OH﹣,负极发生氧化反应,电极方程式为Fe﹣2e﹣═Fe2+,
所以答案是:O2+2H2O+4e﹣═4OH﹣;Fe﹣2e﹣═Fe2+;(3)乙发生析氢腐蚀,铁被氧化,同时生成氢气,离子方程式为Fe+2H+═Fe2++H2↑,所以答案是:Fe+2H+═Fe2++H2↑.

【题目】某研究小组探究电解FeCl2溶液的电极反应产物
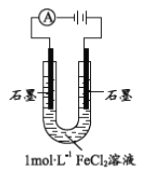
(1)配制1molL-1FeCl2溶液,测得pH=4.91,原因______(用离子方程式表示)。从化合价角度分析, Fe2+具有________。
(2)该小组同学预测电解FeCl2溶液两极的现象:阳极有黄绿色气体产生,阴极有无色气体产生。
该小组同学用右图装置电解1molL-1FeCl2溶液:
①取少量银灰色固体洗涤后,加稀H2SO4有气泡产生,再向溶液中加入________(试剂和现象),证明该固体为Fe。
②该小组同学进一步分析红褐色固体产生的原因,甲同学认为________;乙同学认为2Cl- - 2e- = Cl2↑,Cl2可氧化Fe2+最终生成Fe(OH)3 。
为证实结论,设计方案如下:用实验Ⅰ的装置和1.5v 电压,电解酸化(pH=4.91)的_______,通电5分钟后,阳极无明显现象,证实乙同学的推论不正确。丙同学认为仍不严谨,原因是产生的气体溶于水,继续实验________(操作和现象),进一步证实了乙同学的推论不正确。
(3)该小组同学进一步探究电解1molL-1FeCl2溶液电极产物的影响因素。
实验 | 条件 | 操作及现象 | ||
电压 | pH | 阳极 | 阴极 | |
Ⅰ | 1.5v | 4.91 | 无气泡产生,溶液逐渐变浑浊,5分钟后电极表面析出红褐色固体 | 无气泡产生,4分钟后电极表面有银灰色金属状固体附着 |
Ⅱ | 1.5v | 2.38 | 无气泡产生,溶液出现少量浑浊,滴加KSCN溶液变红色 | 无气泡产生,电极表面有银灰色金属状固体附着 |
Ⅲ | 1.5v | 1.00 | 无气泡产生,溶液无浑浊现象,滴加KSCN溶液变红色 | 有气泡产生,无固体附着 |
Ⅳ | 3.0v | 4.91 | 无气泡产生,溶液逐渐变浑浊,3分钟后电极表面有红褐色固体产生 | 极少量气泡产生,1分钟出现镀层金属 |
Ⅴ | 6.0v | 4.91 | 有气泡产生,遇湿润的淀粉碘化钾试纸变蓝。溶液逐渐变浑浊 | 大量气泡产生,迅速出现镀层金属 |
①对比实验Ⅰ、Ⅱ、Ⅲ可以得出结论:
阳极Fe2+放电时,酸性较强主要生成Fe3+; 酸性较弱主要生成Fe(OH)3 。阴极________。
②对比实验Ⅰ、Ⅳ、Ⅴ可以得出结论:
增大电压,不仅可以改变离子的放电能力,也可以________。
(4)综合分析上述实验,电解过程中电极反应的产物与________有关 。