��Ŀ����
����Ŀ��ij�о�С��̽�����FeCl2��Һ�ĵ缫��Ӧ����
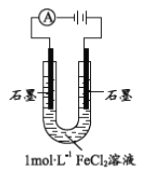
��1������1molL-1FeCl2��Һ�����pH=4.91��ԭ��______�������ӷ���ʽ��ʾ�����ӻ��ϼ۽Ƕȷ����� Fe2+����________��
��2����С��ͬѧԤ����FeCl2��Һ���������������л���ɫ�����������������ɫ���������
��С��ͬѧ����ͼװ�õ��1molL-1FeCl2��Һ��
��ȡ��������ɫ����ϴ�Ӻ�ϡH2SO4�����ݲ�����������Һ�м���________���Լ�������֤���ù���ΪFe��
�ڸ�С��ͬѧ��һ���������ɫ���������ԭ��ͬѧ��Ϊ________����ͬѧ��Ϊ2Cl- - 2e- = Cl2����Cl2������Fe2+��������Fe��OH��3 ��
Ϊ֤ʵ���ۣ���Ʒ������£���ʵ����װ�ú�1.5v ��ѹ������ữ��pH=4.91����_______��ͨ��5���Ӻ���������������֤ʵ��ͬѧ�����۲���ȷ����ͬѧ��Ϊ�Բ��Ͻ���ԭ���Dz�������������ˮ������ʵ��________��������������һ��֤ʵ����ͬѧ�����۲���ȷ��
��3����С��ͬѧ��һ��̽�����1molL-1FeCl2��Һ�缫�����Ӱ�����ء�
ʵ�� | ���� | ���������� | ||
��ѹ | pH | ���� | ���� | |
�� | 1.5v | 4.91 | �����ݲ�������Һ����ǣ�5���Ӻ�缫�����������ɫ���� | �����ݲ�����4���Ӻ�缫����������ɫ����״���帽�� |
�� | 1.5v | 2.38 | �����ݲ�������Һ�����������ǣ��μ�KSCN��Һ���ɫ | �����ݲ������缫����������ɫ����״���帽�� |
�� | 1.5v | 1.00 | �����ݲ�������Һ�������μ�KSCN��Һ���ɫ | �����ݲ��������帽�� |
�� | 3.0v | 4.91 | �����ݲ�������Һ����ǣ�3���Ӻ�缫�����к��ɫ������� | ���������ݲ�����1���ӳ��ֶƲ���� |
�� | 6.0v | 4.91 | �����ݲ�������ʪ��ĵ��۵⻯����ֽ��������Һ����� | �������ݲ�����Ѹ�ٳ��ֶƲ���� |
�ٶԱ�ʵ�������Եó����ۣ�
����Fe2+�ŵ�ʱ�����Խ�ǿ��Ҫ����Fe3+�� ���Խ�����Ҫ����Fe��OH��3 ������________��
�ڶԱ�ʵ�����������Եó����ۣ�
�����ѹ���������Ըı����ӵķŵ�������Ҳ����________��
��4���ۺϷ�������ʵ�飬�������е缫��Ӧ�IJ�����________�й� ��
���𰸡� Fe2++2H2O ![]() Fe(OH)2+2H+ �����Ժͻ�ԭ�� K3[Fe(CN)6] ��Һ����ɫ���� Fe2+-e- = Fe3+����������Fe(OH)3 2mol��L-1 NaCl����KCl����Һ ȡ����������Һ���������KI��Һ����Һ������ ���Խ�ǿʱ��H+�ŵ磬���Խ���ʱ��Fe2+�ŵ� �ı�缫��Ӧ������ �������Һ������ԡ���Դ��ѹ
Fe(OH)2+2H+ �����Ժͻ�ԭ�� K3[Fe(CN)6] ��Һ����ɫ���� Fe2+-e- = Fe3+����������Fe(OH)3 2mol��L-1 NaCl����KCl����Һ ȡ����������Һ���������KI��Һ����Һ������ ���Խ�ǿʱ��H+�ŵ磬���Խ���ʱ��Fe2+�ŵ� �ı�缫��Ӧ������ �������Һ������ԡ���Դ��ѹ
�����������⿼��ʵ�鷽����������ۣ���1��FeCl2����ǿ�������Σ�Fe2������ˮ�ⷴӦ����ԭ����Fe2++2H2O ![]() Fe(OH)2+2H+ ��Fe2�������м��̬���Ⱦ����������־��л�ԭ�ԣ���2�����������ᷴӦ����Fe2����֤������ΪFe����Ҫ��֤��Һ�д���Fe2��������Ҫ����K3[Fe(CN)6] ��Һ����Һ�г�����ɫ������֤������Ϊ�����ʣ���Fe2�����л�ԭ�ԣ�����Fe2����e��=Fe3���������Ϸ���2H2O��2e��=H2����2OH����Fe3����OH����Ӧ����Fe(OH)3����Ҫ���Ա�ʵ�飬������Cl2���������е����ӷ�����Ӧ��������ữ��2mol��L��1��NaCl��KCl����������ˮ�õ���ˮ������ǿ�����ԣ������Ҫȡ����������Һ���������KI��Һ����Һ��������֤ʵ����ͬѧ�����۲���ȷ����3���ٸ���ʵ��I��II��III�����Խ�ǿʱ�������ݲ��������帽�ţ�˵���ŵ����H�������Խ���ʱ��������ð�����н���״���帽�ţ�˵��Fe2���ŵ磻�ڸ���I��IV��Vʵ�飬���缫���������ѹ���������Ըı����ӵķŵ�˳��Ҳ���Ըı�缫�ķ�Ӧ���ʣ���4�������������缫��Ӧ�IJ�����������Һ������ԡ���Դ��ѹ�йء�
Fe(OH)2+2H+ ��Fe2�������м��̬���Ⱦ����������־��л�ԭ�ԣ���2�����������ᷴӦ����Fe2����֤������ΪFe����Ҫ��֤��Һ�д���Fe2��������Ҫ����K3[Fe(CN)6] ��Һ����Һ�г�����ɫ������֤������Ϊ�����ʣ���Fe2�����л�ԭ�ԣ�����Fe2����e��=Fe3���������Ϸ���2H2O��2e��=H2����2OH����Fe3����OH����Ӧ����Fe(OH)3����Ҫ���Ա�ʵ�飬������Cl2���������е����ӷ�����Ӧ��������ữ��2mol��L��1��NaCl��KCl����������ˮ�õ���ˮ������ǿ�����ԣ������Ҫȡ����������Һ���������KI��Һ����Һ��������֤ʵ����ͬѧ�����۲���ȷ����3���ٸ���ʵ��I��II��III�����Խ�ǿʱ�������ݲ��������帽�ţ�˵���ŵ����H�������Խ���ʱ��������ð�����н���״���帽�ţ�˵��Fe2���ŵ磻�ڸ���I��IV��Vʵ�飬���缫���������ѹ���������Ըı����ӵķŵ�˳��Ҳ���Ըı�缫�ķ�Ӧ���ʣ���4�������������缫��Ӧ�IJ�����������Һ������ԡ���Դ��ѹ�йء�