题目内容
【题目】磷酸铁锂是锂电池的电极材料,其成分为LiFePO4、 碳粉和铝箔。对该材料进行资源回收研究,设计实验流程如下:
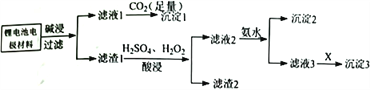
已知:溶解度表:
Li2CO3 | LiOH | LiI | |
0℃ | l.54g | 12.7g | 151g |
100℃ | 0.72g | 13.6g | 179g |
回答下列问题:
(1)由滤液1到沉淀1反应的离子方程式为_______________________________。
(2)向滤渣1加入H2SO4、H2O2混合溶液时,磷酸铁锂溶解,反应的离子方程式为__________________________________。
(3)对滤渣1酸浸操作,下列实验条件控制正确的是(填字母代号) _________________。
a.加入H2O2溶液适当过量,有利于滤渣1的转化
b.适当提高硫酸溶液浓度并搅拌
c.用HNO3代替所加H2SO4和H2O2,节约药品更环保
(4)滤液2加氨水时,调节pH=3,此时溶液中c(Fe3+)=________ (常温下,Ksp[Fe(OH)3]=4.0×10-38)。
(5)向滤液3中加入物质X,根据溶解度表判断X可能是:___________ (填Na2CO3、NaOH或Nal)。
(6)对沉淀3进行洗涤操作,应选择________(选填“冷水”或“热水”)进行洗涤。
(7)磷酸铁锂电池的工作原理为:LiFePO4+ 6C![]() Li1-xFePO4 +LixC6,电池中的电解质可传导Li+。放电时正极的电极反应式为________________________________。
Li1-xFePO4 +LixC6,电池中的电解质可传导Li+。放电时正极的电极反应式为________________________________。
【答案】 AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3- 2LiFePO4+H2O2+8H+=2Li++2Fe3++2H3PO4+2H2O ab 4×10-5 mol·L-1 Na2CO3 热水 Li1-xFePO4+xe-+xLi+=LiFePO4
【解析】根据电极材料的成分LiFePO4、 碳粉和铝箔,分析流程可知锂电池的电极材料经碱浸、过滤溶解铝得到滤液1含有偏铝酸钠,通入足量二氧化碳生成氢氧化铝沉淀(沉淀1),滤渣1经硫酸和过氧化氢酸浸,分离出碳粉(滤渣2),滤液2中含有Fe3+,加入氨水,生成氢氧化铁沉淀(沉淀2),滤液3中含有Li+加入Na2CO3可生成Li2CO3沉淀(沉淀3),结合以上分析。
(1)由滤液1到沉淀1反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3-。
(2)向滤渣1加入H2SO4、H2O2混合溶液时,H2O2作氧化剂将Fe2+氧化为Fe3+,根据得失电子守恒写出反应的离子方程式为:2LiFePO4+H2O2+8H+=2Li++2Fe3++2H3PO4+2H2O。
(3)从加快化学反应速率角度考虑,a.加入H2O2溶液适当过量,有利于滤渣1的转化,a正确;b.适当提高硫酸溶液浓度并搅拌,b正确;c.用HNO3代替所加H2SO4和H2O2,会生成氮的氧化物,对环境有污染,c错误;因此本题答案为ab。
(4)Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=4.0×10-38,pH=3,c(H+)=10-3mol/L,则c(OH-)=10-11mol/L,此时溶液中c(Fe3+)=![]() mol·L-1=4×10-5 mol·L-1。
mol·L-1=4×10-5 mol·L-1。
(5)根据溶解度表知,Li2CO3的溶解度最小,故X可能是:Na2CO3。
(6)由溶解度表知,Li2CO3的溶解度在100℃时小于0℃,所以对沉淀3进行洗涤操作,应选择热水洗涤。
(7)由LiFePO4+ 6C![]() Li1-xFePO4 +LixC6知放电自左向右,且放电时正极发生还原反应,所以放电时正极的电极反应式为Li1-xFePO4+xe-+xLi+=LiFePO4。
Li1-xFePO4 +LixC6知放电自左向右,且放电时正极发生还原反应,所以放电时正极的电极反应式为Li1-xFePO4+xe-+xLi+=LiFePO4。