题目内容
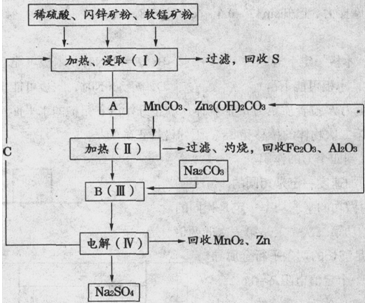
化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
(1)操作①的名称是 。
(2)沉淀A中含有的金属单质有 。
(3)操作②中在酸性下发生反应的离子方程式 。
(4)检验溶液B中含有的金属阳离子常用的试剂是 。
(5)操作③中发生反应的离子方程式为 。
(1)过滤 (2)铁、铜 (3)2Fe2++ H2O2 +2H+="2" Fe3+ +2 H2O (4)KSCN溶液 (5)Fe3+ + 3NH3·H2O = Fe(OH)3↓ + 3NH4+
解析试题分析:(1)操作①加入的过量的铁,由于铁的化学性质比铜都活泼,因此可以把金属铜从盐溶液中置换出来,同时Fe3+能氧化单质铁生成Fe2+,因此在第①得到的滤渣中都含有金属铜和过量的铁,通过过滤得到沉淀和溶液,故答案为:过滤(2)在第①得到的滤渣中都含有金属铜和过量的铁,通过过滤得到沉淀A和溶液A,因此沉淀A中含有金属单质铜、铁,故答案为:铜、铁(3)在酸性过氧化氢溶液中Fe2+能被过氧化氢生成Fe3+,溶液由浅绿色变为棕黄色,生成的Fe3+,能加快过氧化氢的分解,离子方程式2Fe2++ H2O2 +2H+="2" Fe3+ +2 H2O(4)根据(3)Fe2+能被过氧化氢生成Fe3+,溶液B中含有的金属阳离子为Fe3+,由于Fe3+遇SCN-离子,发生反应:Fe3++3SCN-=Fe(SCN)3,溶液呈血红色,所以溶液中滴入KSCN溶液后变红,说明该溶液中含有Fe3+,检验溶液B中含有的金属阳离子常用的试剂是KSCN溶液,故答案为:KSCN溶液;(5)溶液B中含有的金属阳离子为Fe3+,稀氨水中存在下述电离平衡:NH3+H2O NH3?H2O
NH3?H2O NH4++OH-,溶液B中加氨水,发生Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
NH4++OH-,溶液B中加氨水,发生Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
考点:物质分离和提纯的方法和基本操作综合应用;常见的生活环境的污染及治理

 阅读快车系列答案
阅读快车系列答案氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下: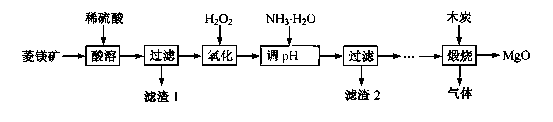
生成氢氧化物沉淀的pH
| | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 9.4 | 6.3 | 1.5 |
| 完全沉淀时 | 12.4 | 8.3 | 2.8 |
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加氨水调节溶液的PH范围为 。
(3)滤渣2 的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C
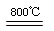 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑MgSO4+C
 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑ MgSO4+3C
 MgO+S↓+3CO↑
MgO+S↓+3CO↑利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是 (填化学式)。
②B中盛放的溶液是 (填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c.稀硫酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O
 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。

就有关物质的分离回答下列问题:
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离的常用方法是: 。
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法: 。
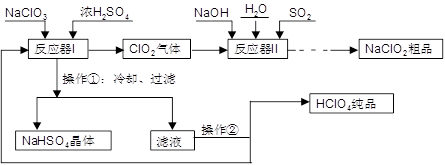


 MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。