题目内容
4.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、达到化学平衡时,若增加容器体积,则正逆反应速率都减小,故A错误;
B、都体现正反应方向,故B错误;
C、达到化学平衡时,应有4v正(O2)=5v正(NO)=5v逆(NO),故C正确;
D、化学反应速率关系是:3v正(NH3)=2v正(H2O),故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
12.常温下,将某可溶性一元碱X0H和盐酸等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明XOH是强碱还是弱碱a=7为强碱,a<7为弱碱.
(2)考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否(选填“是”或“否”).混合液中离子浓度c(Cl-)与 c(X+)的大小关系是c(Cl-)=c(X+).
(3)丙组实验结果分析,XOH是弱碱(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是
(Cl-)>c(X+)>c(H+)>c(OH-).
(4)若甲组实验中a=5,则该混合溶液中:
c(Cl-)-c(X+)=10-5-10-9mol•L-1; c(H+)-c(XOH)=10-9mol•L-1.
| 实验编号 | XOH物质的量浓度(mol•L-1) | 盐酸物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
(2)考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2否(选填“是”或“否”).混合液中离子浓度c(Cl-)与 c(X+)的大小关系是c(Cl-)=c(X+).
(3)丙组实验结果分析,XOH是弱碱(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是
(Cl-)>c(X+)>c(H+)>c(OH-).
(4)若甲组实验中a=5,则该混合溶液中:
c(Cl-)-c(X+)=10-5-10-9mol•L-1; c(H+)-c(XOH)=10-9mol•L-1.
9.强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如图:
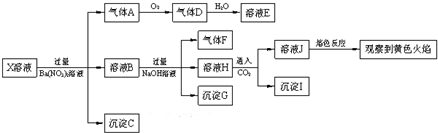
下列结论正确的是( )

下列结论正确的是( )
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F在足量氧气中经催化氧化不可直接生成气体D | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是Fe2+、SO32-、K+和C1- |
 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.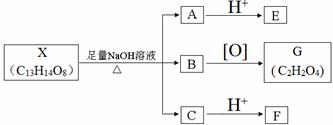
 .
.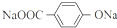 ;X的结构简式是
;X的结构简式是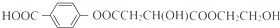 .
.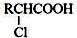 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH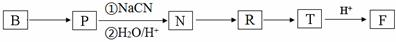
 .
.