题目内容
7.现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg•mol-1.若阿伏加德罗常数用NA表示,则:(1)该气体的物质的量为$\frac{m}{M}$molmol.
(2)该气体所含原子总数为$\frac{2m{N}_{A}}{M}$个.
(3)该气体在标准状况下的体积为$\frac{22.4m}{M}$LL.
(4)该气体溶于水形成500mL溶液(不考虑反应),其溶液的物质的量浓度为$\frac{2m}{M}$mol/L.
分析 (1)根据n=$\frac{m}{M}$计算;
(2)根据N=nNA计算分子数目,含有原子数目为分子的2倍;
(3)根据V=nVm计算;
(4)根据c=$\frac{n}{V}$计算.
解答 解:(1)该气体的物质的量为$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,故答案为:$\frac{m}{M}$mol;
(2)因为一个分子中含两个原子,所以含有的原子数为分子数的2倍,即为2×$\frac{m}{M}$molmol×NAmol-1=$\frac{2m{N}_{A}}{M}$,故答案为:$\frac{2m{N}_{A}}{M}$;
(3)标况下,该气体的体积为$\frac{m}{M}$mol×22.4L/mol=$\frac{22.4m}{M}$L,故答案为:$\frac{22.4m}{M}$L;
(4)该气体溶于水形成500mL溶液(不考虑反应),其溶液的物质的量浓度为$\frac{\frac{m}{M}mol}{0.5L}$=$\frac{2m}{M}$mol/L,故答案为:$\frac{2m}{M}$.
点评 本题考查了有关物质的量的简单计算,题目难度不大,注意掌握物质的量与阿伏伽德罗常数、气体摩尔体积、摩尔质量等物理量之间的转化关系.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
18.已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-284kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-248kJ/mol
已知CO和H2的混合物2.5mol在氧气中充分燃烧放出的热量680kJ,则该混合气体中CO和氢气的物质的量的比值为( )
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-248kJ/mol
已知CO和H2的混合物2.5mol在氧气中充分燃烧放出的热量680kJ,则该混合气体中CO和氢气的物质的量的比值为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 3:2 |
15.在容积固定的密闭容器中,进行下列反应A(g)+B(g)?2C(?)+D(g),此反应符合下列两个图象(其中φ代表物质的百分含量),则下列判断正确的是( )
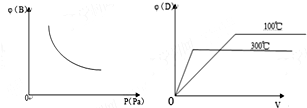

| A. | 物质C不可能为气态 | |
| B. | 正反应为吸热反应 | |
| C. | 该反应,升高温度平衡正向移动 | |
| D. | 300℃下该反应到达平衡状态后,迅速充入He,平衡正向移动 |
2.下列叙述中,正确的是( )
| A. | 太阳能、氢能、风能、生物质能都属于新能源 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 镀层破损后,马口铁比白铁更耐腐蚀 |
12.下列叙述中,不正确的是( )
| A. | 钠原子有强还原性,钠离子有弱氧化性 | |
| B. | 钠离子浓度大的溶液一定显碱性 | |
| C. | 由于钠很活泼,所以一定能从溶液中置换出金属活动性顺序表中钠后面的金属 | |
| D. | 钠是电和热的良导体 |
19.列各项表达中不正确的是( )
| A. | Be2+中电子数和质子数之比一定为1:2 | |
| B. | D216O中质量数之和是质子数之和的两倍 | |
| C. | 氮原子中质子数为7而中子数不一定为7 | |
| D. | 136C表示的碳原子质量数为13,原子序数为6,核内有7个质子 |
16.下列各组混合物中,总质量一定时,二者以不同比例混合,完全燃烧时生成CO2的质量不一定的是( )
| A. | 甲烷、辛醛 | B. | 乙炔、乙烯 | C. | 乙烯、庚烯 | D. | 苯、甲苯 |
4.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| D. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) |