题目内容
9.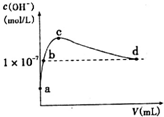 常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
分析 A.a点溶液中的溶质是NaOH,水电离出的c(H+)=10-pH;
B.常温下,c(OH-)=1×10-7mol/L,溶液呈中性;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,碳酸根离子水解生成碳酸氢根离子但程度较小;
D.d点溶液中,溶液呈中性,溶液中存在电荷守恒,根据电荷守恒判断.
解答 解:A.a点溶液中的溶质是NaOH,水电离出的c(H+)=10-pH=1×10-10mol•L-1,故A正确;
B.常温下,c(OH-)=1×10-7mol/L,溶液呈中性,则c(OH-)=c(H+),所以c(H+)=1×10-7mol•L-1,故B正确;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,碳酸根离子水解生成碳酸氢根离子但程度较小,所以离子浓度大小顺序是c(Na+)>c(CO32-)>c(HCO3-),故C错误;
D.d点溶液中,溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒,根据电荷守恒得c(Na+)=2c(CO32-)+c(HCO3-),故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,结合电荷守恒进行解答,注意计算碱性溶液中水电离出氢离子和氢氧根离子的方法.

练习册系列答案
相关题目
19.某学习小组利用图1装置制取乙酸乙酯.
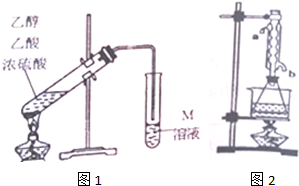
请回答下列问题:
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.

| 相对分子质量 | 沸点(℃) | |
| 乙醇 | 46 | 78.5 |
| 乙酸 | 60 | 117.9 |
| 乙酸乙酯 | 88 | 77.1 |
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.
4.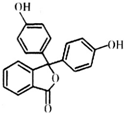 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 能发生加聚反应生成高分子化合物 | |
| C. | 酚酞的水解产物中含有醇羟基 | |
| D. | 1 mol该物质最多能与含4 mol NaOH的烧碱溶液反应 |
14.下列有关${\;}_{8}^{16}$O2的说法正确的是( )
| A. | ${\;}_{8}^{18}$O2是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | ${\;}_{8}^{18}$O2是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
18.化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是( )
| A. | “地沟油”可以生产“生物燃料”,生物燃料本质上能量来源于太阳能 | |
| B. | 消除水体中的HgCl2污染可利用微生物使其转化为有机汞CH3HgCl | |
| C. | 人体内没有能使纤维素水解成葡萄糖的酶,但可以加强胃肠蠕动,有助于消化,因此纤维素是人类的营养食物 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是经提纯的二氧化硅 |
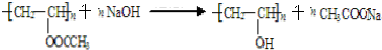 ;反应类型是取代反应.
;反应类型是取代反应. .
.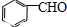 能发生银镜反应,该反应的化学方程式是
能发生银镜反应,该反应的化学方程式是 .
.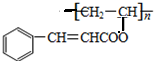 ,关于A的性质下列说法正确的是acd(填字母).
,关于A的性质下列说法正确的是acd(填字母).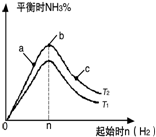 在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0; 前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: