题目内容
【题目】随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示.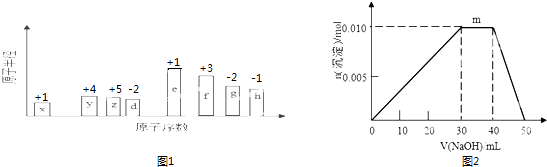
根据判断出的元素回答问题:
(1)z在元素周期表的位置是 .
(2)比较d、f简单离子的半径大小(用化学符号表示,下同)>;比较d、g元素的简单气态氢化物的稳定性大小> .
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 .
(4)已知1mol固体e的单质在足量d2气体中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式 .
(5)由上述元素组成的离子化合物 Q:eh 和W:e2gd4 , 若电解含2molQ和2molW的混合水溶液,当阳极产生44.8L气体(标准状况下,且不考虑气体的溶解和损失)时,电路中转移电子的物质的量为mol.
(6)上述元素可组成盐R:zx4f(gd4)2 . 向盛有10mL1molL﹣1R溶液的烧杯中滴加1molL﹣1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图2:①R溶液中,离子浓度由大到小的顺序是 .
②写出m点发生反应的离子方程式 .
③若在R溶液中改加20mL 1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
【答案】
(1)第二周期VA族
(2)O2﹣;Al3+;H2O;H2S
(3)![]() (或
(或 ![]()
![]() )
)
(4)2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJ?mol﹣1
(5)6
(6)c(SO ![]() )>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣);NH
)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣);NH ![]() +OH﹣=NH3?H2O;0.022
+OH﹣=NH3?H2O;0.022
【解析】解:从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.(1)Z为N元素,在元素周期表的位置是第二周期VA族,故答案为:第二周期VA族;(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2﹣)>r(Al3+),非金属性越强,对应氢化物越稳定,故稳定性:H2O>H2S,故答案为:O2﹣;Al3+;H2O;H2S;(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为: ![]() (或
(或 ![]()
![]() ),故答案为:
),故答案为: ![]() (或
(或 ![]()
![]() );(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,则该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJmol﹣1 , 故答案为:2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJmol﹣1;(5)电解含2mol NaCl和2molNa2SO4的混合水溶液,阳极产生44.8L气体,标准状况下物质的量为2mol,阳极首先发生反应:2Cl﹣﹣2e﹣=Cl2↑,反应产生1mol氯气,转移2mol电子,然后发生反应:4OH﹣﹣4e﹣=2H2O+O2↑,n(O2)=2mol﹣1mol=1mol,反应转移电子的物质的量是4mol,所以电路中转移电子的物质的量为6mol,故答案为:6;(6)①盐NH4Al(SO4)2在溶液中发生电离:NH4Al(SO4)2=NH4++Al3++2SO42﹣ , NH4+、Al3+发生水解反应,消耗水电离产生的OH﹣ , 使溶液中c(H+)增大,当最终溶液达到平衡时,c(H+)>c(OH﹣),溶液显酸性;由于Al3+水解程度大于NH4+ , 因此c(NH4+)>c(Al3+),盐水解程度是微弱的,主要以盐电离产生的离子存在,因此溶液中离子浓度大小关系是:c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣),故答案为:c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣);②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为NH4++OH﹣=NH3H2O,故答案为:NH4++OH﹣=NH3H2O;③10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4 , Al3++3OH﹣=Al(OH)3↓
);(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,则该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJmol﹣1 , 故答案为:2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJmol﹣1;(5)电解含2mol NaCl和2molNa2SO4的混合水溶液,阳极产生44.8L气体,标准状况下物质的量为2mol,阳极首先发生反应:2Cl﹣﹣2e﹣=Cl2↑,反应产生1mol氯气,转移2mol电子,然后发生反应:4OH﹣﹣4e﹣=2H2O+O2↑,n(O2)=2mol﹣1mol=1mol,反应转移电子的物质的量是4mol,所以电路中转移电子的物质的量为6mol,故答案为:6;(6)①盐NH4Al(SO4)2在溶液中发生电离:NH4Al(SO4)2=NH4++Al3++2SO42﹣ , NH4+、Al3+发生水解反应,消耗水电离产生的OH﹣ , 使溶液中c(H+)增大,当最终溶液达到平衡时,c(H+)>c(OH﹣),溶液显酸性;由于Al3+水解程度大于NH4+ , 因此c(NH4+)>c(Al3+),盐水解程度是微弱的,主要以盐电离产生的离子存在,因此溶液中离子浓度大小关系是:c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣),故答案为:c(SO42﹣)>c(NH4+)>c(Al3+)>c(H+)>c(OH﹣);②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O,离子方程式为NH4++OH﹣=NH3H2O,故答案为:NH4++OH﹣=NH3H2O;③10mL 1molL﹣1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42﹣的物质的量为0.02mol,20mL 1.2 molL﹣1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH﹣为0.048mol,由SO42﹣+Ba2+=BaSO4↓,可知SO42﹣不足,故可以得到0.02mol BaSO4 , Al3++3OH﹣=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH﹣为0.048mol﹣0.03mol=0.018mol,![]() +OH﹣=NH3H2O
+OH﹣=NH3H2O
0.01mol 0.01mol
反应剩余OH﹣为0.018mol﹣0.01mol=0.008mol,
Al(OH)3+OH﹣=AlO2﹣+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol﹣0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.(1)Z是N元素,在元素周期表的位置是第二周期VA族;(2)电子层结构相同的离子,核电荷数越大离子半径越小;非金属性越强,对应氢化物越稳定;(3)四原子共价化合物,可以是NH3、H2O2、C2H2等;(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,注明聚集状态、反应热书写热化学方程式;(5)电解含2mol NaCl和2molNa2SO4的混合水溶液,阳极产生44.8L气体,标准状况下物质的量为2mol,
阳极首先发生反应:2Cl﹣﹣2e﹣=Cl2↑,然后发生反应:4OH﹣﹣4e﹣=2H2O+O2↑;(6)①R是NH4Al(SO4)2 , 溶液中Al3+、NH4+均水解使溶液呈酸性,但Al3+比 NH4+水解程度更大;②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH﹣反应生成NH3H2O;③根据n=cV计算n(Al3+ )、n(NH ![]() )、n(SO
)、n(SO ![]() )、n(Ba2+)、n(OH﹣),根据SO
)、n(Ba2+)、n(OH﹣),根据SO ![]() 、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH﹣=Al(OH)3↓、NH
、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH﹣=Al(OH)3↓、NH ![]() +OH﹣=NH3H2O、Al(OH)3+OH﹣=AlO
+OH﹣=NH3H2O、Al(OH)3+OH﹣=AlO ![]() +2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.
+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.


