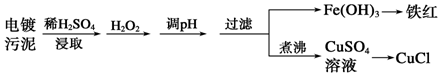
题目内容
6.下列排列顺序正确的是( )| A. | 热稳定性:HBr<HCl<HF | B. | 原子半径:I<Br<Cl | ||
| C. | 酸性:HClO4<HBrO4<HIO4 | D. | 非金属性:F<Cl<Br |
分析 A.非金属性越强,对应氢化物越稳定;
B.同主族从上到下原子半径增大;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.同主族从上到下非金属性减弱.
解答 解:A.非金属性F>Cl>Br,对应氢化物热稳定性:HBr<HCl<HF,故A正确;
B.同主族从上到下原子半径增大,则原子半径为I>Br>Cl,故B错误;
C.非金属性Cl>Br>I,对应最高价含氧酸的酸性为HClO4>HBrO4>HIO4,故C错误;
D.同主族从上到下非金属性减弱,则非金属性F>Cl>Br,故D错误;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
5.除去某溶液里溶解的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( )
| A. | NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | KNO3溶液(NaCl):加热蒸发得浓溶液后,降温 | |
| C. | NaCl溶液(Br2):加CCl4,分液 | |
| D. | KNO3溶液(AgNO3):加过量KCl溶液,过滤 |
2.下列说法不正确的是( )
| A. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | 用热的纯碱溶液去油污效果更好 | |
| C. | 制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法 | |
| D. | 室温下,向0.1mol/L的HF溶液中加入少量水溶液显碱性的物质,HF的电离程度一定增大 |
1.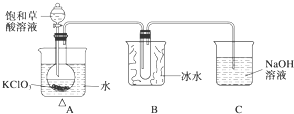 某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃.
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.
(1)写出制备ClO2的化学方程式:
KClO3+1H2C2O4═2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请将实验步骤以及预期现象和结论填入下表.限选实验试剂:1mol•L-1 H2SO4溶液、0.1mol•L-1 HCl溶液、0.01mol•L-1 KMnO4溶液、澄清石灰水.
 某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).
某研究性学习小组组装了下图所示的装置制备ClO2气体(加热装置用“△”表示),反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率).已知:①ClO2是一种黄绿色有刺激性气味的气体,熔点-59℃,沸点11.0℃.
②草酸是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸,它还是一种还原性较强的物质.
(1)写出制备ClO2的化学方程式:
KClO3+1H2C2O4═2KHCO3+2ClO2↑
(2)A装置中还缺少的一样仪器名称是温度计,B装置的作用是将ClO2冷凝收集.
(3)C装置吸收尾气后,溶液中含有NaOH、NaClO2、NaClO3等溶质,小组成员认为C中还可能含有Na2CO3,试分析可能的原因是过量的草酸与KHCO3反应:HOOC-COOH+KHCO3=CO2↑+H2O+HOOC-COOK,逸出的CO2与NaOH溶液反应生成Na2CO3,CO2+2NaOH=Na2CO3+H2O;或因KClO3具有较强氧化性,将草酸氧化成CO2,逸出的CO2与NaOH溶液反应生成Na2CO3.
(4)小组成员查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:只存在CaC2O4.
②基于假设2,设计实验方案,进行实验.请将实验步骤以及预期现象和结论填入下表.限选实验试剂:1mol•L-1 H2SO4溶液、0.1mol•L-1 HCl溶液、0.01mol•L-1 KMnO4溶液、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl. | |
| 步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4. |
11.若要配制480mL0.1mol/L的硫酸铜溶液,以下操作正确的是( )
| A. | 称取7.68g硫酸铜,加入500mL水 | B. | 称取12.5g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取12.0g胆矾配成500mL溶液 |
18. 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
| D | 氨水 | 硝酸银溶液 | 先产生白色沉淀后沉淀逐渐溶解 |
| A. | A | B. | B | C. | C | D. | D |
15.2015年10月,屠哟哟因发现青篙素和双氢青篙素获诺贝尔生理学或医学奖,已知青蒿素的化学式为C15H22O5,则1mol青蒿素中氢原子的物质的量为( )
| A. | 1mol | B. | 15mol | C. | 22mol | D. | 5mol |
16.电化学在日常生活中用途广泛,图①是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图②是Cr2O72-的工业废水的处理,下列说法正确的是( )

| A. | 图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图②的电解池中,有0.084 g阳极材料参与反应,阴极会有33.6 mL的气体产生 | |
| C. | 图①中发生的还原反应是:Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 若图①中3.6 g镁溶解产生的电量用以图②废水处理,理论可产生10.7 g氢氧化铁沉淀 |