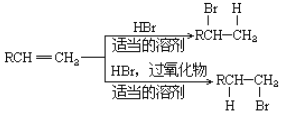
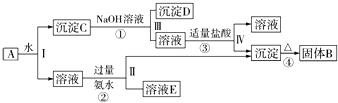
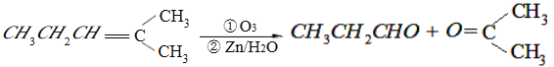题目内容
【题目】B、D、C、A、E 五种元素的原子序数顺序依次增大,其中只有E为金属元素,D、C 元素在元素周期表中位置相邻,在一定条件下,B 的单质可以分别和A、C、D 的单质化合生成甲、乙、丙化合物,C 的单质和D 的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10 个电子,下图为相互转化关系:
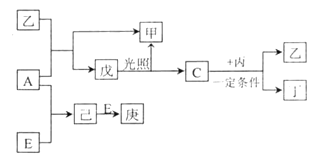
请回答下列问题:
(1)写出E 的原子结构示意图_____________。
(2)写出C、D 氢化物的稳定性由强到弱的顺序_________(用化学式表示)。
(3)A、B、D 三种元素形成的化合物中其中一种可用作化肥,写该化合物的电子式__________。
(4)写出C与丙反应的化学反应方程式________________。
(5)写出工业上从海水中制取A 的离子反应方程式_______________。
(6)工业上通过如下转化可制得含A 元素的钾盐KAO3 晶体:
NaA溶液![]() NaAO3
NaAO3![]() KAO3晶体
KAO3晶体
Ⅰ Ⅱ
①完成Ⅰ中反应的总化学方程式:___________________。
NaA+□H2O![]() □NaAO3+□
□NaAO3+□
②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是_____________。
【答案】 ![]() H2O>NH3
H2O>NH3 ![]() 4NH3+5O2
4NH3+5O2![]() 4NO+6H2O 2Cl-+2H2O
4NO+6H2O 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 1 3 1 3H2 室温下,氯酸钾在水中的溶解度明显小于其他晶体
Cl2↑+H2↑+2OH- 1 3 1 3H2 室温下,氯酸钾在水中的溶解度明显小于其他晶体
【解析】本题主要考查氮、氯元素的性质。根据题意可以判断B、D、C、A、E五种元素分别是氢、氮、氧、氯、铁。
(1)E的原子结构示意图:![]() 。
。
(2)非金属性:O>N,所以C、D氢化物的稳定性由强到弱的顺序为H2O>NH3。
(3)A、B、D三种元素形成的化合物中其中一种可用作化肥,该化合物是氯化铵,其电子式: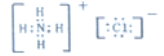 。
。
(4)丙是氨,C单质与丙反应的化学方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
(5)工业上从海水中制取A单质反应是电解饱和食盐水,反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(6)①Ⅰ中反应的总化学方程式:NaA+3H2O![]() NaAO3+3H2↑。
NaAO3+3H2↑。
②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是室温下,氯酸钾在水中的溶解度明显小于其他晶体。