��Ŀ����
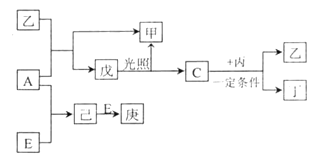
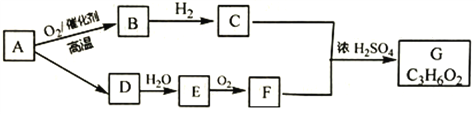
����Ŀ��ij�����A������Al2��SO4��3��Al2O3��Fe2O3 �� ��һ�������¿�ʵ����ͼ��ʾ������֮���ת����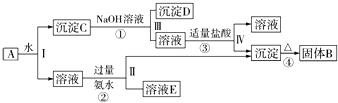
����ʾ������C�����ǻ����ٲ���������NaOH��Һ�ǹ����ģ�����������Ϣ�ش��������⣺
��1�����IJ��ж�����Һ�ͳ����ķ����ȡ�ķ����� ��
��2������������ͼ��Ӧ��ϵ��д������B��E�������ʵĻ�ѧʽ������B����ҺE ��
��3��д���ܷ�Ӧ�Ļ�ѧ����ʽ�����١��ڡ��ۡ���Ӧ�����ӷ���ʽ���������� ��
���𰸡�
��1������
��2��Al2O3��K2SO4����NH4��2SO4��NH3?H2O
��3��2Al��OH��3 ![]() Al2O3+3H2O��Al2O3+2OH���TAlO2��+H2O��Al3++3NH3?H2O�TAl��OH��3��+3NH4+��AlO2��+H2O+H+�TAl��OH��3��
Al2O3+3H2O��Al2O3+2OH���TAlO2��+H2O��Al3++3NH3?H2O�TAl��OH��3��+3NH4+��AlO2��+H2O+H+�TAl��OH��3��
���������⣺KAl��SO4��2����ˮ��Al2O3��Fe2O3��������ˮ�������A��ˮ�ܽ����Һ����KAl��SO4��2 �� ������Al2O3��Fe2O3��������м�NaOH��Һ��Fe2O3����Ӧ��Al2O3����NaOH��Һ��Ӧ����NaAlO2 �� ��NaAlO2��Һ����������ɵ�Al��OH��3������Al��OH��3���ȷֽ�����Al2O3������Һ�мӹ�����ˮ����Һ�������ˮ��Ӧ��Al3+���������õ�����������������Һ��ʣ�����K2SO4����NH4��2SO4��NH3H2O����1��I��II��III��IV�IJ��ж�����Һ�ͳ����ķ����ȡ�ķ����ǹ��ˣ����Դ��ǣ����ˣ���2������BΪAl2O3 �� ��ҺEΪK2SO4����NH4��2SO4��NH3H2O�����Դ��ǣ�Al2O3��K2SO4����NH4��2SO4��NH3H2O����3����Ϊ���������ķֽ⣬��Ӧ�Ļ�ѧ����ʽΪ2Al��OH��3 ![]() Al2O3+3H2O���١��ڡ��۷�Ӧ�����ӷ���ʽ�ֱ�Ϊ��Al2O3+2OH���TAlO2��+H2O����Al3++3NH3H2O�TAl��OH��3��+3NH4+����AlO2��+H2O+H+�TAl��OH��3�������Դ��ǣ�2Al��OH��3
Al2O3+3H2O���١��ڡ��۷�Ӧ�����ӷ���ʽ�ֱ�Ϊ��Al2O3+2OH���TAlO2��+H2O����Al3++3NH3H2O�TAl��OH��3��+3NH4+����AlO2��+H2O+H+�TAl��OH��3�������Դ��ǣ�2Al��OH��3 ![]() Al2O3+3H2O��Al2O3+2OH���TAlO2��+H2O��Al3++3NH3H2O�TAl��OH��3��+3NH4+��AlO2��+H2O+H+�TAl��OH��3����
Al2O3+3H2O��Al2O3+2OH���TAlO2��+H2O��Al3++3NH3H2O�TAl��OH��3��+3NH4+��AlO2��+H2O+H+�TAl��OH��3����

����Ŀ��������ʾ��O2������������ҺpH��������������ij��ȤС��̽����ͬ������KI��O2�ķ�Ӧ��ʵ�����¡�
װ�� | �ձ��е�Һ�� | ����5���Ӻ� |
| ��2 mL1 mol/LKI��Һ+5�ε��� | �����Ա仯 |
��2 mL1 mol/LKI��Һ+5�ε���+2 mL0.2 mol/L HCl | ��Һ���� | |
��2 mL1 mol/LKI��Һ+5�ε���+2 mL0.2 mol/L KCl | �����Ա仯 | |
��2 mL1 mol/LKI��Һ+5�ε���+2 mL0.2 mol/L CH3COOH | ��Һ��������ɫ�Ϣ�dz |
��1��ʵ���������I2�����ӷ���ʽ��___________��
��2��ʵ��۵�Ŀ����_________________________________________________________________��
��3��ʵ��ܱȢ���Һ��ɫdz��ԭ����________��
��4��Ϊ��һ��̽��KI��O2�ķ�Ӧ�����ϱ��е�װ�ü�������ʵ�飺
�ձ��е�Һ�� | ����5Сʱ�� |
��2 mLpH=8.5����KOH��1mol/L KI��Һ+5�ε��� | ��Һ���Ա��� |
��2 mLpH=10����KOH��1mol/L KI��Һ+5�ε��� | �����Ա仯 |
I������ʵ�������ͬѧ���������pH=10ʱO2��������I-�������������װ�ý���ʵ�飬��֤���롣

i���ձ�a�е���ҺΪ____��
ii��ʵ�����������˲��벻������֧�ָý��۵�ʵ�������ǣ�ͨ��O2��_______��
������ͬѧ��pH=10��KOH��Һ�������ۣ��еμӵ�ˮ����Һ�ȱ�����Ѹ����ɫ���������ɫ�����Һ�к���IO3-����ɫ��ԭ���ǣ������ӷ���ʽ��ʾ��____________��
��5����С��ͬѧ��ʵ����̽��������巴˼���Ʋ�ʵ��ٵ����������ԭ�������______��ʵ������������ԭ�������_______��