题目内容
2.下列各指定原子序数的元素,不能形成AB2型化合物的是( )| A. | 6和8 | B. | 16和12 | C. | 12和9 | D. | 16和8 |
分析 根据AB2型化合物中A的化合价可能为+2价或+4价,B为-1价或-2价,以及各选项中元素的种类和性质进行分析.
解答 解:A.原子序数为6和8的元素分别为C元素和O元素,可以生成C0、CO2等化合物,故A不选;
B.原子序数为16和12的元素分别为S元素和Mg元素,可以生成MgS化合物,故B选;
C.原子序数为12和9的元素分别为Mg元素和F元素,可以生成MgF2,故C不选;
D.原子序数为16和8的元素分别为S元素和O元素,可以生成S02、SO3等化合物,故D不选.
故选B.
点评 本题考查原子序数与物质的性质,题目难度不大,注意短周期元素形成的单质和化合物的性质.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
18.下列各项表述正确的是( )
| A. | 羟基的电子式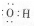 | B. | 醛基官能团符号-COH | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 异丁烷的结构简式:CH3CH(CH3)CH3 |
13.下列四个图象所反映的内容与相应反应符合的是(a、b、c、d均大于0)( )
| A. | 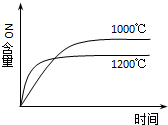 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. | 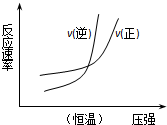 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 | |
| C. | 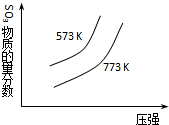 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 | |
| D. | 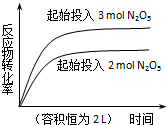 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
7.含有非极性共价键的化合物是( )
| A. | CO2 | B. | CaCl2 | C. | C2H6 | D. | NaOH |
11.燃料电池是一种新型电池,它主要是利用燃料燃烧原理把化学能直接转化为电能.氢氧燃料电池的基本反应是:X极:$\frac{1}{2}$O2(g)+H2O(l)+2e-═2OH-;Y极:H2(g)+2OH--2e-═2H2O(l).下列说法正确的是( )
| A. | X是正极 | B. | Y是正极 | ||
| C. | Y极发生还原反应 | D. | 电子由X极移向Y极 |