题目内容
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
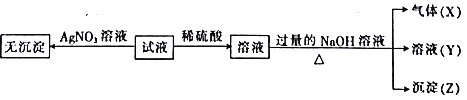
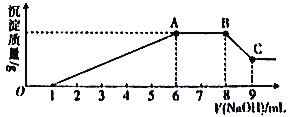
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种,沉淀Z的化学式____________。
(2)检验气体X的方法是______________________;
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________。
(4)A点对应的固体质量为__________g。
(5)通过实验I可以确定该溶液中一定存在的阴离子是_______________,推算该溶液中阴离子的浓度为_________mol L-l,检验该阴离子的方法是:_____________________。
【答案】4 Mg(OH)2 使湿润的红色石蕊试纸变蓝(或遇蘸有浓盐酸的玻璃棒冐白烟 Al(OH)3+OH-=AlO2-+2H2O 0.136 NO3- 0.08 取液,加入铜片,再加少量浓硫酸,有无色气体产生,在空气中变为红棕色。
【解析】
溶液无色,则不存在有色离子,即亚铁离子、高锰酸根离子;溶液显酸性,则不存在硅酸根离子和亚硫酸根离子;该溶液与硝酸银溶液混合后无沉淀生成,则不存在氯离子,因此一定含有硝酸根离子;该溶液与稀硫酸反应得不到沉淀,说明不存在钡离子,所得溶液与过量的氢氧化钠溶液混合生成气体X、溶液Y和沉淀Z,X是氨气,一定含有铵根离子;沉淀一定是氢氧化镁,含有镁离子;根据图像可知开始时氢氧化钠首先中和氢离子,然后沉淀金属阳离子,沉淀达到最大值后开始与铵根结合生成氨气,然后沉淀开始减少,最后不再发生变化,所以溶解的沉淀一定是氢氧化铝,含有铝离子。
(1)根据分析可知不进行实验就可以推断出表中的离子一定不存在的有4种,即亚铁离子、硅酸根离子、高锰酸根离子和亚硫酸根离子,根据分析可知沉淀Z的化学式为![]() ;
;
(2)氨气是碱性气体,检验氨气的方法是用镊子夹一块湿润的红色石蕊试纸靠近气体X,试纸变蓝,则说明X为氨气;
(3)实验Ⅱ的图象中BC段发生氢氧化铝的溶解,对应的离子方程式为![]() ;
;
(4)A点消耗氢氧化钠6mL,与金属阳离子反应的氢氧化钠是5mL,物质的量为0.005mol。溶解氢氧化铝消耗氢氧化钠是1mL,物质的量是0.001mol,所以生成的氢氧化铝是0.001mol,则与镁离子反应的氢氧化钠是0.002mol,氢氧化镁是0.001mol,所以对应的固体质量为![]() ;
;
(5)通过实验Ⅰ可以确定该溶液中一定存在的阴离子是硝酸根离子;
与氢离子反应的氢氧化钠是1mL,物质的量是0.001mol,即氢离子是0.001mol;与铵根反应的氢氧化钠是2mL,物质的量是0.002mol,即铵根是0.002mol,根据溶液显电中性可知硝酸根的物质的量是![]() ,所以该溶液中阴离子的浓度为
,所以该溶液中阴离子的浓度为![]() ;
;
检验硝酸根离子的方法,可通过其在酸性条件下具有的强氧化性来实现,取液,加入铜片,再加少量浓硫酸,有无色气体产生,在空气中变为红棕色,则证明溶液中存在硝酸根。