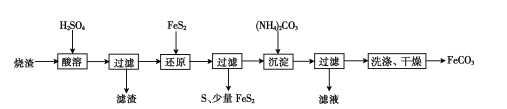
题目内容
【题目】某实验小组在T1温度下,向容积为1L的恒容密闭容器中,同时通入0.1mol CO(g)和0.1mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。

(1)0~10min内,CO的平均反应速率为_____________
(2)T1温度下,该反应的平衡常数K为_______________(用分数表示)。
(3)已知:I.H2的燃烧热 △H=-285.8 kJ·mol-1;
II.CO的燃烧热 △H=-283 kJ·mol-1;
III.H2O(g)![]() H2O(l) △H=-44 kJ·mol-1。则a=______________
H2O(l) △H=-44 kJ·mol-1。则a=______________
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1、c(H2)=0.4 mol·L-1、c(CO2)=0.4 mol·L-1,则该反应在下一时刻将_______ (填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是___________________。
【答案】0.003 mol/(L·min) ![]() -41.2 向正反应方向进行 Q=
-41.2 向正反应方向进行 Q=![]() ,所以该反应向正反应方向进行
,所以该反应向正反应方向进行
【解析】
(1)根据图中信息可知,0~10min内,CO2的平均反应速率为v(CO2)=![]() =0.003 mol/(L·min);根据反应CO(g)+H2O(g)
=0.003 mol/(L·min);根据反应CO(g)+H2O(g)![]() CO2(g)+H2(g)中化学反应速率之比等于计量数之比可知,v(CO)=v(CO2)=0.003 mol/(L·min);
CO2(g)+H2(g)中化学反应速率之比等于计量数之比可知,v(CO)=v(CO2)=0.003 mol/(L·min);
(2)T1温度下,根据三段式可知,
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始时的浓度(mol/L) 0.1 0.1 0 0
改变的浓度(mol/L) 0.03 0.03 0.03 0.03
平衡时的浓度(mol/L) 0.07 0.07 0.03 0.03
该反应的平衡常数K=![]() =
=![]() ;
;
(3)已知:I.H2(g)+ ![]() O2(g)=H2O(l) △H1=-285.8 kJ·mol-1;
O2(g)=H2O(l) △H1=-285.8 kJ·mol-1;
II.CO(g)+ ![]() O2(g)=CO2 (g) △H2=-283 kJ·mol-1;
O2(g)=CO2 (g) △H2=-283 kJ·mol-1;
III.H2O(g)![]() H2O(l) △H3=-44 kJ·mol-1
H2O(l) △H3=-44 kJ·mol-1
根据盖斯定律,由II- I + III得反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-283 kJ·mol-1-(-285.8 kJ·mol-1)-44 kJ·mol-1=a kJ·mol-1。则a=-41.2;
CO2(g)+H2(g) △H=-283 kJ·mol-1-(-285.8 kJ·mol-1)-44 kJ·mol-1=a kJ·mol-1。则a=-41.2;
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1、c(H2)=0.4 mol·L-1、c(CO2)=0.4 mol·L-1,则该反应在下一时刻将向正反应方向进行,判断依据是Q=![]() ,所以该反应向正反应方向进行。
,所以该反应向正反应方向进行。

 夺冠训练单元期末冲刺100分系列答案
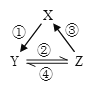
夺冠训练单元期末冲刺100分系列答案【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D