题目内容
【题目】含20.0g NaOH的稀溶液与稀硝酸完全反应时,放出28.7kJ的热量,表示该反应的热化学方程式正确的是( )
A.NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l)△H=+28.7kJmol﹣1
B.NaOH+HNO3=NaNO3+H2O△H=﹣28.7kJmol﹣1
C.NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l)△H=﹣57.4kJmol﹣1
D.NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJ
【答案】C
【解析】解:n(NaOH)= ![]() =0.5mol,与稀硝酸完全反应时,放出28.7kJ的热量,则1molNaOH与稀硝酸完全反应时,放出热量为28.7kJ×2=57.4 kJ,中和反应为放热反应,焓变为负,在溶液中的离子反应,只有水为液体,则该反应的热化学方程式为NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJmol﹣1,
=0.5mol,与稀硝酸完全反应时,放出28.7kJ的热量,则1molNaOH与稀硝酸完全反应时,放出热量为28.7kJ×2=57.4 kJ,中和反应为放热反应,焓变为负,在溶液中的离子反应,只有水为液体,则该反应的热化学方程式为NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJmol﹣1,
故选C.

 名师点拨卷系列答案
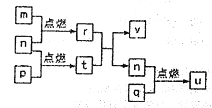
名师点拨卷系列答案【题目】用如图装置做相应实验,收集方法及所加试剂、现象、结论均正确的是
选项 | 气体 | 试剂 | 现象 | 结论 |
|
A | X | 酸性KMnO4溶液 | 溶液褪色 | X一定是SO2 气体 | |
B | NH3 | 酚酞溶液 | 溶液变红色 | 氨水呈碱性 | |
C | NO2 | 淀粉一KI溶液 | 溶液变蓝色 | NO2有还原性 | |
D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
A. A B. B C. C D. D
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下: 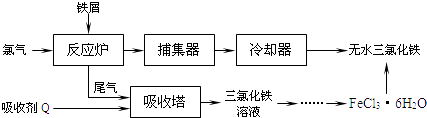
(1)试写出吸收塔中反应的离子方程式: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39).
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c molL﹣1 Na2S2O3溶液滴定用去V mL.(已知:I2+2S2O32﹣═2I﹣+S4O62﹣) ①滴定终点的现象是: .
②求样品中氯化铁的质量分数(写出计算过程) .
【题目】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O (未配平)。
0.1mol·L-1KMnO4酸性溶液的体积/mL | 0. 6mol·L-1 H2C2O4溶液的体积/mL | H2O的积/mL | 实验温度/℃ | 溶液褪色时所需时间/min | |
实验1 | 10 | V1 | 35 | 25 | |
实验2 | 10 | 10 | 30 | 25 | |
实验3 | 10 | 10 | V2 | 50 |
(1)表中V1=___________mL , V2=___________mL。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为2 min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________________。
(4)已知50 ℃时c(MnO![]() )~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO
)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO![]() )~t的变化曲线示意图________。
)~t的变化曲线示意图________。