��Ŀ����
����Ŀ��ijС������H2C2O4��Һ�������ữ��KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱͨ���ⶨ����KMnO4��Һ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�������֪��KMnO4��H2C2O4��H2SO4��K2SO4��MnSO4��CO2����H2O ��δ��ƽ����
0.1mol��L��1KMnO4������Һ�����/mL | 0. 6mol��L��1 H2C2O4��Һ�����/mL | H2O�Ļ�/mL | ʵ���¶�/�� | ��Һ��ɫʱ����ʱ��/min | |
ʵ��1 | 10 | V1 | 35 | 25 | |
ʵ��2 | 10 | 10 | 30 | 25 | |
ʵ��3 | 10 | 10 | V2 | 50 |
(1)����V1=___________mL , V2=___________mL��
(2)̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������____________��
(3)ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ2 min�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(H2C2O4)��________________��
(4)��֪50 ��ʱc(MnO![]() )����Ӧʱ��t�ı仯������ͼ�������������������䣬��������ͼ�У�����25 ��ʱc(MnO
)����Ӧʱ��t�ı仯������ͼ�������������������䣬��������ͼ�У�����25 ��ʱc(MnO![]() )��t�ı仯����ʾ��ͼ________��
)��t�ı仯����ʾ��ͼ________��

���𰸡� 5 30 2��3 1��2 0.025 mol��L��1��min��1 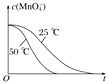
��������(1)�ɱ���ʵ��2��ʵ��1֪���¶���ͬ��������Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�졣������Һ�������ҲӦ����ͬ��Ϊ50mL,����֪������V1��Һ���Ϊ60-35-10=5mL ,V2=50-10-10=30mL��
(2)�����ϱ�����ʵ��2��ʵ��3��Ӧ��Ũ����ͬ���¶Ȳ�ͬ��������̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ������أ���ʵ������ 2��3�������ϱ�����ʵ��2��ʵ��1��Ӧ���¶���ͬ��Ũ�Ȳ�ͬ.����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ��ģ���ʵ����Ӧ����1��2��
(3)�ɻ�ѧ��Ӧ��ϵ��֪��2KMnO4 ��5H2C2O4��3H2SO4=K2SO4��2MnSO4��10CO2����8H2O����� KMnO4 �����ʵ���Ϊ0.01![]() 0.1=0.001mol, �����H2C2O4 �����ʵ���Ϊ0.005
0.1=0.001mol, �����H2C2O4 �����ʵ���Ϊ0.005![]() 0.6=0.003mol, 2KMnO4
0.6=0.003mol, 2KMnO4 ![]() 5H2C2O4��ϵ֪��H2C2O4���������Բμӷ�Ӧ��n(H2C2O4)= 0.01
5H2C2O4��ϵ֪��H2C2O4���������Բμӷ�Ӧ��n(H2C2O4)= 0.01![]() 0.1
0.1![]() 5/2=0.0025mol
5/2=0.0025mol
ʵ�������KMnO4��Һ����ɫʱ��Ϊ2 min������H2C2O4��2 min��ƽ����Ӧ����v(H2C2O4)��0.0025mol/(0.05L![]() 2 min)= 0.025 mol��L��1��min��1���𰸣�0.025 mol��L��1��min��1
2 min)= 0.025 mol��L��1��min��1���𰸣�0.025 mol��L��1��min��1
(4)����Ӱ�컯ѧ��Ӧ���ʵ����ؿ�֪�������¶Ȼ�ѧ��Ӧ���ʼӿ죬��֪50 ��ʱc(MnO![]() )����Ӧʱ��t�ı仯������ͼ�������������������䣬25 ��ʱ��ѧ��Ӧ���ʼ���������ʱ��䳤������c(MnO
)����Ӧʱ��t�ı仯������ͼ�������������������䣬25 ��ʱ��ѧ��Ӧ���ʼ���������ʱ��䳤������c(MnO![]() )��t�ı仯����ʾ��ͼΪ
)��t�ı仯����ʾ��ͼΪ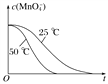 ��
��

 ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�