题目内容
10.铜、铁都是日常生活中常见的金属,它们的单质及26.其化合物在科学研究和工农业生产中具有广泛用途.请回答以下问题:(1)超细铜粉可用作导电材料、催化剂等,其制备方法如图:

(1)①Cu2+的价电子排布图
 ;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).②SO42-的空间构型为正四面体形,SO32-离子中心原子的杂化方式为sp3杂化.
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-.
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4•H2O晶体.
①下列说法正确的是c
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度
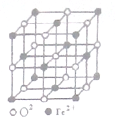
(4)FeO晶胞结构如右图所示,FeO晶体中Fe2+配位数为6,若该晶胞边长为acm,则该晶体密度为$\frac{288}{{a}^{3}.{N}_{A}}$g/cm3.
分析 (1)①Cu2+的价层电子数是9个,所以Cu2+的价电子为3d9;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小;
②SO42-的价层电子对数=4+$\frac{1}{2}$(6+2-4×2)=4;SO32-离子的价层电子对数=3+$\frac{1}{2}$(6+2-3×2)=4;
(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式;
(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键;
d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素;
②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(4)以亚铁离子为中心,沿X、Y、Z三轴进行切割,从而确定亚铁离子配位数;由图可知,该晶胞中亚铁离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧离子个数=1+12×$\frac{1}{4}$=4,
设晶胞边长为a cm,晶胞体积为a3cm3,结合ρ=$\frac{m}{V}$计算.
解答 解:(1)①Cu2+的价层电子数是9个,所以Cu2+的价电子排布图为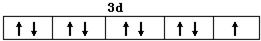 ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;
故答案为: ,N>O>S;
,N>O>S;
②SO42-的价层电子对数=4+$\frac{1}{2}$(6+2-4×2)=4,所以空间构型为正四面体型;SO32-离子的价层电子对数=3+$\frac{1}{2}$(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;
故答案为:正四面体形;sp3杂化;
(2)由流程图可知向Cu(NH3)4SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
故答案为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4++SO42-;
(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,故a错误;
b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,故b错误;
c. Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,故c正确;
d. Cu(NH3)4SO4组成元素中电负性最大的是氧元素,故d错误,
故答案为:c;
②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
故答案为:乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;
(4)以亚铁离子为中心,沿X、Y、Z三轴进行切割,可知亚铁离子配位数为$\frac{3×8}{4}$=6;由图可知,该晶胞中亚铁离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧离子个数=1+12×$\frac{1}{4}$=4,
设晶胞边长为a cm,晶胞体积为a3cm3,则ρ=$\frac{\frac{72g/mol×4}{{N}_{A}}}{{a}^{3}c{m}^{3}}$=$\frac{288}{{a}^{3}.{N}_{A}}$g/cm3,
故答案为:6;$\frac{288}{{a}^{3}.{N}_{A}}$g/cm3.
点评 本题考查制备实验及晶胞计算,为高频考点,把握物质结构与性质、晶胞计算方法等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 乙烯的结构简式为CH2CH2,乙烷的结构简式为CH3CH3 | |
| B. | 乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不都在同一平面上 | |
| C. | 乙烯分子中含有碳碳双键,乙烷分子中含有碳碳单键,双键不如单键稳定,导致乙烯的性质比乙烷活泼 | |
| D. | 乙烯分子中因含有不饱和键,导致乙烯能使酸性KMnO4溶液和溴的四氯化碳溶液褪色 |
| A. | 常温下硝酸铵溶于水是一个能自发进行的吸热过程,说明该过程的△S>0 | |
| B. | 反应 A(g)+3B(g)?2C(g)达平衡后,升高温度,平衡常数增大,则正反应的△H<0 | |
| C. | 已知H+(aq)+OH- (aq)=H2O(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100 mL 1 mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,冷却后再AgNO3溶液 |
| A. | HCN碳原子为sp杂化,分子为直线型 | |
| B. | CO2分子中碳原子为sp2杂化,分子为V型 | |
| C. | CH2=CH2分子中碳原子为sp3杂化,分子为三角型 | |
| D. | 乙炔分子中碳原子为sp2杂化,分子为直线型 |
| A. | $\frac{10}{11}$ | B. | $\frac{7}{11}$ | C. | $\frac{6}{11}$ | D. | $\frac{4}{11}$ |
| A. | H2S和NH3价电子总数均是8 | |
| B. | 次氯酸分子的结构式为:H-Cl-O | |
| C. | HS-和HCl均是含一个极性键的18电子粒子 | |
| D. | 1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值) |
 用没食子酸制造墨水主要利用了( )类化合物的性质.
用没食子酸制造墨水主要利用了( )类化合物的性质.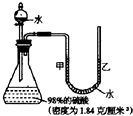 如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.这个实验说明了浓硫酸的密度大于水的密度、浓硫酸溶于水的时候放出热量,这个事实告诉我们为了防止发生事故,在稀释浓硫酸时,一定要将浓硫酸沿容器壁慢慢倒入水中,并不断搅拌.
如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.这个实验说明了浓硫酸的密度大于水的密度、浓硫酸溶于水的时候放出热量,这个事实告诉我们为了防止发生事故,在稀释浓硫酸时,一定要将浓硫酸沿容器壁慢慢倒入水中,并不断搅拌.