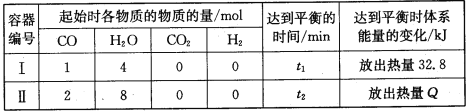
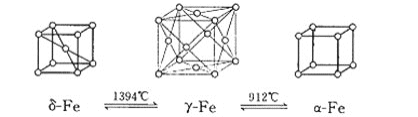
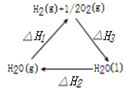
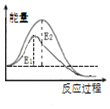
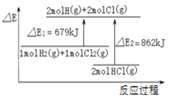
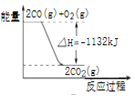
题目内容
【题目】已知水的电离平衡曲线如图所示,下列说法正确的是
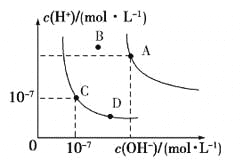
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
【答案】B
【解析】
A. 水的离子积常数只与温度有关,温度相同,则Kw相同,温度升高,则Kw增大,根据图示可知温度:A>B>C=D,所以水的离子积常数关系为:Kw(A)>Kw(B)>Kw(C)=Kw(D),错误;
B.保持温度不变,向水中加入醋酸钠固体,CH3COO-发生水解反应,消耗水电离产生的H+,使溶液中c(OH-)>c(H+),但是温度不变,所以Kw不变,可从C点到D点,正确;
C. B点对应的温度下,pH=4的硫酸c(H+)=10-4mol/L,pH=10的氢氧化钠溶液,c(OH-)>10-4mol/L,二者等体积混合,碱过量,溶液显碱性,则由于中性溶液的pH<7,所以此时溶液的pH可能=7,正确;
D. 温度升高,水的离子积常数增大,所以不可实现由C点到D点,错误。

【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________