题目内容
【题目】Ⅰ:现有两个体积相等的恒容密闭容器,向甲容器中加入1molA和1 molB,乙容器中加入1molX和3molY,两容器中分别发生下列两个反应,反应开始时甲、乙两容器的反应条件相同。

回答下列问题:
(1)反应达到平衡时,甲、乙两容器中平均反应速率v(A)与v(X)的大小关系是___。(填序号)。
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.无法比较
(2)甲中反应达到平衡后,若给甲容器升温,正反应速率将___(填“增大”、“减小”或“不变”)。
(3)表示乙中反应达到平衡的标志是___(填序号)。
①X、Y、Z的物质的量之比为1:3:2
②X、Y、Z的浓度不再发生变化
③容器中的温度不再发生变化
④3v正(Y)=2v逆(Z)
Ⅱ:工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ·mol1
CO2(g)+H2(g) △H=-41kJ·mol1
某化学兴趣小组同学研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
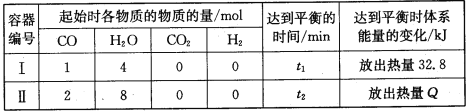
(1)容器Ⅰ中反应达到平衡时,CO的转化率为___。
(2)容器Ⅱ中反应的平衡常数K=___。
(3)下列叙述正确的是___(填字母)。
a.平衡时,两容器中H2 的体积分数相等
b.容器Ⅱ反应达到平衡状态时,Q>65.6
c.反应开始时,两容器中反应的速率相等
【答案】D 增大 ②③ 80% 1 a
【解析】
I(1)反应达到平衡时,甲、乙两容器中的反应体系不同,无法进行比较反应速率的大小;
(2)给甲容器升温,正逆反应速率均增大;
(3)①X、Y、Z的物质的量之比为1:3:2,无法判断同一物质的正逆反应速率是否相等;
②X、Y、Z的浓度不再发生变化时,同一物质的正逆反应速率相等,达到平衡状态;
③甲容器为良好导热容器,反应始终与外界温度相同,乙两容器为绝热容器,反应达到平衡状态时,温度不再改变,则容器的温度不再发生变化,可判断达到平衡状态;
④v正(Y)、v逆(Z)表示的方向相反, v正(Y):v逆(Z) =2:3不等于化学计量数之比,未达到平衡状态;
Ⅱ:(1)根据转化率=![]() ×100%计算;
×100%计算;
(2)容器Ⅱ中的反应与容器Ⅰ相同,则反应两边气体的计量数之和相等,且初始比例相同,则两容器为等效;
(3)a.两容器为等效平衡,则平衡时,两容器中H2 的体积分数相等;
b.容器Ⅱ反应达到平衡状态时,CO的转化率为80%,反应1.6mol;
c.反应开始时,容器II中各浓度大,则容器II的反应的速率快。
I(1)反应达到平衡时,甲、乙两容器中的反应体系不同,无法进行比较反应速率的大小,答案为D。
(2)给甲容器升温,正逆反应速率均增大;
(3)①X、Y、Z的物质的量之比为1:3:2,无法判断同一物种的正逆反应速率是否相等,不能判断是否达到平衡状态,与题意不符,①错误;
②X、Y、Z的浓度不再发生变化时,同一物质的正逆反应速率相等,达到平衡状态,符合题意,②正确;
③甲容器为良好导热容器,反应始终与外界温度相同,乙两容器为绝热容器,反应达到平衡状态时,温度不再改变,则容器的温度不再发生变化,可判断达到平衡状态,符合题意,③正确;
④v正(Y)、v逆(Z)表示的方向相反, v正(Y):v逆(Z) =2:3不等于化学计量数之比,未达到平衡状态,与题意不符,④错误;
答案为②③;
Ⅱ:(1)根据方程式可知,反应1molCO时释放41kJ的热量,现平衡时,释放32.8kJ的热量,则反应的n(CO)=![]() =0.8mol,转化率=
=0.8mol,转化率=![]() ×100%=80%;
×100%=80%;
(2)容器Ⅱ中的反应与容器Ⅰ相同,方程式两边气体的计量数之和相等,且初始比例相同,则两容器为等效,则容器II的转化率也为80%,温度相同,则K相同,容器II中,平衡时的浓度分别为![]() 、
、![]() 、
、![]() 、
、![]() ,则K=
,则K= =1;
=1;
(3)a.两容器为等效平衡,则平衡时,两容器中H2 的体积分数相等,符合题意,a正确;
b.容器Ⅱ反应达到平衡状态时,CO的转化率为80%,反应1.6mol,Q=41×1.6=65.6kJ,与题意不符,b错误;
c.反应开始时,容器II中各物质浓度大,则容器II的反应的速率快,与题意不符,c错误;
答案为a。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】氮的氧化物是造成大气污染的主要物质。
(1)用活性炭还原NO的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
浓度mol/L 时间min | NO | N2 | CO2 |
0 | 10 | 0 | 0 |
10 | 5 | 2.5 | 2.5 |
20 | 2 | 4 | 0.25 |
①在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是____。
②在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正___v逆(填“>”“<”或“=”)。
(2)工业上由N2、H2来制备NH3。不同温度下,向三个相同的容器中投入相同的反应物进行反应,测得不同温度时平衡混合物中NH3的物质的量分数随压强增大而变化如图所示。
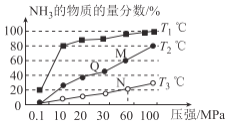
①M点的v正_______Q点的v正(填“>”“<”或“=”)。
②图中三条曲线对应的温度分别为T1、T2、T3,其中温度最高的是____。
③恒温恒容条件下,能说明反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡状态的是____(填选项字母)
2NH3(g)达到平衡状态的是____(填选项字母)
A. 2v(N2)=v(NH3) B.c2(NH3)/[c(N2)c3(H2)]保持不变
C.反应器中的压强不再发生变化 D.3 molH-H键断裂的同时,有2molN-H键断裂
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
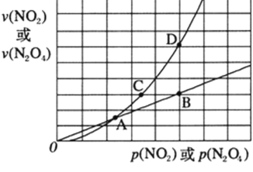
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是______。