题目内容
【题目】在晶体中,微观粒子是有规律排布的。而实际上的晶体与理想结构或多或少会产生偏离,这种偏离称为晶体的缺陷。由于晶体缺陷,氧化铁FexO中的x常常不确定。
(1)请写出铁原子基态电子排布式___________________。
(2)Fe2+与Fe3+相比,较稳定的是___________,请从二者结构上加以解释_______________。
(3)硫氰根离子和异硫氰根离子都可用SCN-表示,碳原子都处于中央,则碳原子的轨道杂化类型为____________________。其中异硫氰根离子与CO2是等电子体,异硫氰根离子的电子式为________________。Fe3+与SCN-可以形成配位数![]() 的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_____________。
的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为_____________。
(4)如图:铁有![]() 、
、![]() 、
、![]() 三种同素异形体,三种晶体在不同温度下能发生转化。
三种同素异形体,三种晶体在不同温度下能发生转化。
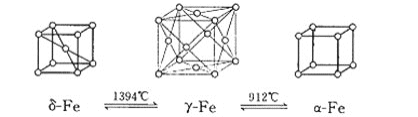
请问:![]() 、
、![]() 、
、![]() 这三种晶胞的棱长之比为:___________。
这三种晶胞的棱长之比为:___________。
【答案】[Ar]3d64s2 Fe3+ Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6,Fe3+的3d能级处于半充满状态,是一种较稳定的结构 sp ![]() FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl 2
FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl 2![]() :3
:3![]() :3
:3
【解析】
(1)根据构造原理,书写Fe原子核外电子排布式;
(2)原子核外各个轨道电子数处于全满、半满或全空时是稳定状态;
(3)根据价层电子对理论分析C原子杂化方式;根据等电子体结构相似书写异硫氰根离子的电子式;
(4)根据各自结构的相对位置分析计算。
(1)Fe是26号元素,原子核外有26个电子,根据核外电子排布规律可知铁原子基态电子排布式为[Ar]3d64s2;
(2)Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6,Fe3+的3d能级处于半充满状态,是一种较稳定的结构,所以Fe3+比Fe2+稳定;
(3)SCN-中碳原子都处于中央,碳周围有两个![]() 键,没有孤电子对,所以碳原子按sp方式杂化,互为等电子体的粒子结构相似,所以根据CO2分子的结构可判断异硫氰根离子的电子式为
键,没有孤电子对,所以碳原子按sp方式杂化,互为等电子体的粒子结构相似,所以根据CO2分子的结构可判断异硫氰根离子的电子式为![]() ,FeCl3与KSCN在水溶液按1:5反应,反应的化学方程式为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl;
,FeCl3与KSCN在水溶液按1:5反应,反应的化学方程式为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl;
(4)设铁原子半径为a,根据晶胞结构图,![]() 晶体中晶胞的棱长为
晶体中晶胞的棱长为![]() ,γ晶体中晶胞的棱长为
,γ晶体中晶胞的棱长为![]() ,
,![]() 晶体中晶胞的棱长为2a,所以三种晶胞的棱长之比为2
晶体中晶胞的棱长为2a,所以三种晶胞的棱长之比为2![]() :3
:3![]() :3。
:3。

【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____________,△H____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)=_____mol·L-1, C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为_____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_________;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_____________。
A(g)+B(g)的平衡常数的值为_____________。
【题目】向CH3COONa稀溶液中加入(或通人)少许X物质,其溶液中部分微粒的浓度变化如表所示(溶液温度不变)。
微粒 | H+ | OH- | CH3COO- | CH3COOH |
物质的量浓度 | 增大 | 减小 | 减小 | 增大 |
X物质是下列物质中的( )
A.氢氧化钠B.蒸馏水C.氯化氢D.磷酸钠