题目内容
【题目】(1)请用序号填空:
①13C与14C ②正丁烷与异丁烷
③CH3CH3与CH3CH2CH3 ④![]()
属于同位素的是______;属于同系物的是______;属于同分异构体的是______。
(2)写出下列物质的电子式:
NaCl____________ NH3______________
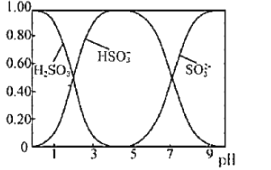
(3)第三周期元素中的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是___________,呈两性的氢氧化物是___________。半径最大的原子是___________,氢化物最稳定的元素是__________。
(4)1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量,写出该反应的热化学方程式______________________;
【答案】① ③ ② ![]()
 HClO4 NaOH Al(OH)3 Na Cl N2(g) + O2(g) =2NO(g)ΔH=+68kJ/ mol
HClO4 NaOH Al(OH)3 Na Cl N2(g) + O2(g) =2NO(g)ΔH=+68kJ/ mol
【解析】
(1)①13C与14C都是碳元素的不同核素,属于同位素;
②正丁烷与异丁烷分子式相同,结构不同,属于同分异构体;
③CH3CH3与CH3CH2CH3结构相似,都是烷烃,在分子组成上相差一个“-CH2-”原子团,二者互为同系物;
④![]() 分子式相同,分子结构中的两个氯原子在空间上都处于邻位,结构也相同,属于同种物质;
分子式相同,分子结构中的两个氯原子在空间上都处于邻位,结构也相同,属于同种物质;
属于同位素的是①;属于同系物的是③;属于同分异构体的是②;
(2)NaCl属于离子化合物,由钠离子和氯离子构成,电子式为![]() ;NH3是共价化合物,电子式为
;NH3是共价化合物,电子式为 ;
;
(3)同周期元素随核电荷数增大,非金属性越强,金属性逐渐减弱,最高价氧化物对应的水化物的酸性越强,碱性逐渐减弱,第三周期非金属性最强的为Cl元素,则最高价氧化物对应的水化物的酸性最强的是HClO4,第三周期金属性最强的元素为Na,则最高价氧化物对应的水化物的碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3。同周期元素随核电荷数增大,半径逐渐减小,第三周期半径最大的原子是Na,同周期元素随核电荷数增大,非金属性越强,气态氢化物的稳定性逐渐增强,第三周期氢化物最稳定的元素是Cl;
(4)1molN2(g)与适量O2(g)起反应,生成NO(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO(g)△H=+68kJmol-1。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案