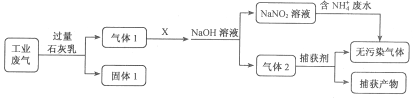
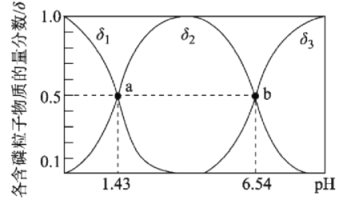
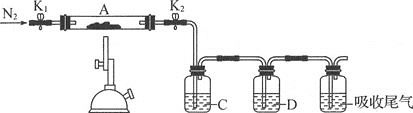
题目内容
【题目】用沉淀滴定法快速测定待测溶液中c(Cl-)。
滴定的主要步骤:
a.取待测溶液25.00mL于锥形瓶中。
b.加入25.00mL 0.1000mol·L-1 AgNO3溶液(过量),使Cl-完全转化为AgCl沉淀。
c.加入少量硝基苯并振荡,使其覆盖沉淀,避免沉淀与溶液接触。
d.加入NH4Fe(SO4)2溶液作指示剂。
e.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀。
f.重复上述操作两次。
三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
g.数据处理。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
(1)滴定终点的现象为______________________________。
(2)步骤c中加入硝基苯的目的是______________________________。
(3)计算待测溶液中c(Cl-)=__________mol·L-1。
(4)判断下列操作对c(Cl-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果__________;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则测定结果__________。
【答案】溶液变红,且半分钟不褪色 防止AgCl沉淀转化为AgSCN沉淀 0.06 偏高 偏低
【解析】
该滴定方法的原理是,利用已知浓度和体积的硝酸银溶液与氯离子反应,然后通过已知浓度的NH4SCN溶液滴定过量的Ag+,从而求出与Ag+反应的Cl-的物质的量,滴定过程中存在数量关系n(Cl-)~n沉淀(Ag+)~[n总(Ag+)-n(NH4SCN)];NH4Fe(SO4)2溶液作指示剂,当Ag+反应完全后,Fe3+会与SCN-反应使溶液变成血红色,加入少量硝基苯可以使生成的氯化银沉淀离开溶液,如果不加硝基苯,在水溶液中部分氯化银可以转化成AgSCN。
(1)NH4Fe(SO4)2溶液作指示剂,当Ag+反应完全后,Fe3+会与SCN-反应使溶液变成血红色,故滴定终点的现象为:溶液变红,且半分钟不褪色;
(2)加入少量硝基苯可以使生成的氯化银沉淀离开溶液,如果不加硝基苯,在水溶液中部分氯化银可以转化成AgSCN,故答案为:防止AgCl沉淀转化为AgSCN沉淀;
(3)滴定过程中存在数量关系n(Cl-)~n沉淀(Ag+)~[n总(Ag+)-n(NH4SCN)],滴定过程消耗的NH4SCN溶液体积为![]() (第一组数据偏差较大,故舍去),所以
(第一组数据偏差较大,故舍去),所以![]() =0.06mol/L,故答案为0.06mol/L;
=0.06mol/L,故答案为0.06mol/L;
(4)①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则会导致计算式中n总(Ag+)大于实际值,从而导致所测溶液浓度偏高;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则会导致计算式中n(NH4SCN)偏大,测定结果偏低;故答案为:偏高;偏低。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】在三个容积均为2L的密闭容器中按不同方式投入反应物,发生反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
容器 | 容器类型 | 起始温度/℃ | 起始物质的量/mol | 平衡时H2物质的量/mol | |||
CO | H2O | CO2 | H2 | ||||
Ⅰ | 恒温容器 | 800 | 1.2 | 0.6 | 0 | 0 | 0.4 |
Ⅱ | 恒温容器 | 900 | 0.7 | 0.1 | 0.5 | 0.5 | |
Ⅲ | 绝热容器 | 800 | 0 | 0 | 1.2 | 0.8 | |
下列说法正确的是
A.容器Ⅰ中反应经10min建立平衡,0~10min内,平均反应速率v(CO)=0.04 mol·L-1·min-1
B.若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,平衡将逆向移动
C.达到平衡时,容器Ⅱ中反应吸收的热量小于0.1a kJ
D.达平衡时,容器Ⅲ中n(CO)<0.48 mol