题目内容
【题目】亚磷酸(H3PO3)是二元弱酸,主要用于农药中间体以及有机磷水处理药剂的原料。常温下,向1L0.500mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示,下列说法正确的是
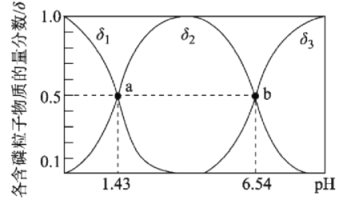
A.a、b两点时,水电离出的c水(OH-)之比为1.43:6.54
B.b点对应溶液中存在:c(Na+)=3c(HPO32-)
C.反应H3PO3+HPO32-![]() 2H2PO3-的平衡常数为105.11
2H2PO3-的平衡常数为105.11
D.当V(NaOH)=1 L 时,c(Na+)>c(H2PO3-)>c(OH-)>c(H+)
【答案】C
【解析】
A. a点为H3PO3与NaH2PO3的混合液,溶液显酸性,水电离出的c水(OH-)等于溶液中的氢氧根离子浓度,则a点溶液中![]() ,b点为Na2HPO3与NaH2PO3的混合液,溶液显酸性,水电离出的c水(OH-)等于溶液中的氢氧根离子浓度,则b点溶液中
,b点为Na2HPO3与NaH2PO3的混合液,溶液显酸性,水电离出的c水(OH-)等于溶液中的氢氧根离子浓度,则b点溶液中![]() ,则a、b两点时,水电离出的c水(OH-)之比为10-5.11,A项错误;
,则a、b两点时,水电离出的c水(OH-)之比为10-5.11,A项错误;
B. 由图可知,b点溶液呈酸性,则c(H+)>c(OH),且有c(H2PO3)=c(HPO32),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH)+c(H2PO3)+2c(HPO32),则c(Na+)<c(H2PO3)+2c(HPO32)=3c(HPO32-),B项错误;
C. 反应H3PO3+HPO32-![]() 2H2PO3-的平衡常数为
2H2PO3-的平衡常数为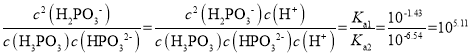 ,C项正确;
,C项正确;
D. 当V(NaOH)=1 L 时,H3PO3与NaOH物质的量相等,二者恰好反应生成NaH2PO3溶液,由图可知,该溶液显酸性,则c(Na+)>c(H2PO3-)>c(H+)>c(OH-),D项错误;
答案选C。

【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g),下列说法正确的是
CH3OH(g),下列说法正确的是
容器 | 温度/K | 物质的平衡浓度/mol/L | |||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A.该反应的正反应吸热
B.达到平衡时,容器I中反应物转化率比容器II中的大
C.达到平衡时,容器II中c(H2)大于容器I中c(H2)的两倍
D.达到平衡时,容器III中的反应速率比容器I中的大
【题目】用沉淀滴定法快速测定待测溶液中c(Cl-)。
滴定的主要步骤:
a.取待测溶液25.00mL于锥形瓶中。
b.加入25.00mL 0.1000mol·L-1 AgNO3溶液(过量),使Cl-完全转化为AgCl沉淀。
c.加入少量硝基苯并振荡,使其覆盖沉淀,避免沉淀与溶液接触。
d.加入NH4Fe(SO4)2溶液作指示剂。
e.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀。
f.重复上述操作两次。
三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
g.数据处理。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
(1)滴定终点的现象为______________________________。
(2)步骤c中加入硝基苯的目的是______________________________。
(3)计算待测溶液中c(Cl-)=__________mol·L-1。
(4)判断下列操作对c(Cl-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果__________;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则测定结果__________。
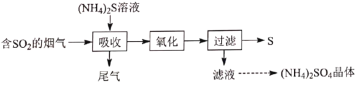
【题目】焦亚硫酸钠(Na2S2O5)是一种可溶于水的白色或淡黄色小晶体,食品级焦亚硫酸钠可作为贮存水果的保鲜剂等。某化学研究兴趣小组欲自制焦亚硫酸钠并探究其部分化学性质等。
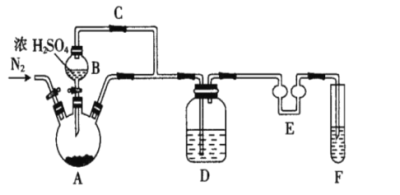
(1)制备Na2S2O5,如图(夹持及加热装置略)
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)
焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(l)
①F中盛装的试剂是__,作用是__。
②通入N2的作用是__。
③Na2S2O5晶体在__(填“A”或“D”或“F”)中得到,再经离心分离,干燥后可得纯净的样品。
④若撤去E,则可能发生__。
(2)设计实验探究Na2S2O5的性质,完成表中填空:
预测Na2S2O5的性质 | 探究Na2S2O5性质的操作及现象 | |
探究一 | Na2S2O5的溶液呈酸性 | ① |
探究二 | Na2S2O5晶体具有还原性 | 取少量Na2S2O5晶体于试管中,滴加1mL2mol·L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 |
①__。(提供:pH试纸、蒸馏水及实验必需的玻璃仪器)
②探究二中反应的离子方程式为__(KMnO4→Mn2+)
(3)利用碘量法可测定Na2S2O5样品中+4价硫的含量。
实验方案:将agNa2S2O5样品放入碘量瓶(带磨口塞的锥形瓶)中,加入过量c1mol·L-1的碘溶液,再加入适量的冰醋酸和蒸馏水,充分反应一段时间,加入淀粉溶液,__(填实验步骤),当溶液由蓝色恰好变成无色,且半分钟内溶液不恢复原色,则停止滴定操作重复以上步骤两次记录数据。(实验中必须使用的试剂有c2mol·L-1的标准Na2S2O3溶液;已知:2Na2S2O3+I2=Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)]利用Na2S2O5和FeSO4·7H2O先后分两个阶段处理含Cr2O72-的废水,先将废水中Cr2O72-全部还原为Cr3+,将Cr3+全部转化为Cr(OH)3而除去,需调节溶液的pH范围为___。
{已知:Ksp[Cr(OH)3]=6.4×10-31,lg2≈0.3,c(Cr3+)<1.0×10-5mol·L-1时视为完全沉淀}