题目内容
4.下列离子方程式中正确的是( )| A. | 向碳酸钠溶液中加入足量的盐酸 CO32-+2H+═CO2↑+H2O | |
| B. | 单质铁和三氯化铁溶液反应生成氯化亚铁 Fe+Fe3+═2Fe2+ | |
| C. | 金属钠与水反应生成氢氧化钠和氢气 Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铵晶体和石灰粉共热产生氨气 NH4++OH-═NH3↑+H2O |
分析 A.反应生成氯化钠、水、二氧化碳;
B.电子、电荷不守恒;
C.电子不守恒;
D.固体反应生成氨气,不属于离子反应.
解答 解:A.向碳酸钠溶液中加入足量的盐酸的离子反应为CO32-+2H+═CO2↑+H2O,故A正确;
B.单质铁和三氯化铁溶液反应生成氯化亚铁的离子反应为Fe+2Fe3+═3Fe2+,故B错误;
C.金属钠与水反应生成氢氧化钠和氢气的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.氯化铵晶体和石灰粉共热产生氨气,为固体之间的反应,不属于离子反应,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意电子、电荷守恒及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
14.某小组在某温度下测定溶液的pH时发现,0.01mol/L的NaOH溶液中,c(H+)•c(OH-)=10-12(mol•L-1)2,则该小组在该温度下测得0.1mol•L的NaOH溶液pH值应为( )
| A. | 13 | B. | 13 | C. | 11 | D. | 10 |
12. 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果不正确的是( )| A. | 反应过程中,沉淀最多时的质量为78g | |
| B. | 反应过程中,Al3+离子有$\frac{1}{3}$转化为Al(OH)3沉淀,则加入的NaOH溶液的体积可能为3.5L | |
| C. | AlCl3溶液的浓度为2.0 mol/L | |
| D. | 当V(NaOH)=4.0 L时,得到的溶液中Na+、Cl-浓度一定不相等 |
19.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 由N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1热化学方程式可知,当反应中转移6NA电子时,反应放出的热小于92.4 kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
9.分子式为C10H17Br的有机物,其结构不可能是( )
| A. | 只含1个碳碳双键的直链有机物 | B. | 含2个碳碳双键的直链有机物 | ||
| C. | 含1个碳碳双键的环状有机物 | D. | 含1个碳碳三键的直链有机物 |
14.在溶液中能大量共存的一组离子或分子是( )
| A. | NH${\;}_{4}^{+}$、H+、NO${\;}_{3}^{-}$、HCO${\;}_{3}^{-}$ | B. | K+、Al3+、SO${\;}_{4}^{2-}$、NH3•H2O | ||
| C. | Na+、K+、SO${\;}_{3}^{2-}$、Cl2 | D. | Na+、Cl-、CO${\;}_{3}^{2-}$、OH- |
 、
、 、
、 、
、 .
.
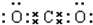
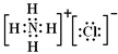
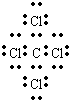
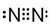
 .
.