题目内容
13.写出下列物质的电子式(1)Na2O2

(2)CO2
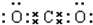
(3)NH4Cl

(4)CCl4
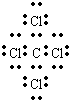
(5)N2
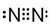
(6)NH3
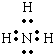
(7)Na3N
 .
.
分析 首先判断化合物是离子化合物还是共价化合物;
若是离子化合物,其电子式 由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况.
解答 解:(1)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
(2)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: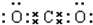 ,故答案为:
,故答案为: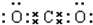 ;
;
(3)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故答案为:
,故答案为: ;
;
(4)CCl4是共价化合物,碳原子分别与4个氯原子通过一对共用电子对结合,CCl4电子式为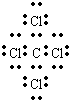 ,故答案为:
,故答案为: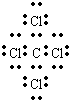 ;
;
(5)氮气中存在氮氮三键,氮气的电子式为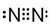 ,故答案为:
,故答案为: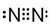 ;
;
(6)NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为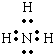 ,故答案为:
,故答案为: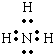 ;
;
(7)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为: ,故答案为:
,故答案为: .
.
点评 本题考查化学键的类型以及电子式的书写,题目难度不大,注意离子键与共价键的区别以及电子式的书写方法,原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列离子方程式中正确的是( )
| A. | 向碳酸钠溶液中加入足量的盐酸 CO32-+2H+═CO2↑+H2O | |
| B. | 单质铁和三氯化铁溶液反应生成氯化亚铁 Fe+Fe3+═2Fe2+ | |
| C. | 金属钠与水反应生成氢氧化钠和氢气 Na+H2O═Na++OH-+H2↑ | |
| D. | 氯化铵晶体和石灰粉共热产生氨气 NH4++OH-═NH3↑+H2O |
8.能够用键能解释的是( )
| A. | 氮气的化学性质比氧气稳定 | B. | 常温常压下,溴呈液体,碘为固体 | ||
| C. | 稀有气体一般很难发生化学反应 | D. | 硝酸易挥发,硫酸难挥发 |
5.下列物质性质的变化规律与分子间作用力有关的是( )
| A. | F2、CI2、Br2、I2的熔、沸点逐渐升高 | |
| B. | 碳化硅、晶体硅的熔、沸点很高 | |
| C. | NaF、NaCI、NaBr、NaI的熔点依次降低 | |
| D. | HF、HCI、HBr、HI的热稳定性依次 |
3.在水溶液中能大量共存的离子组是( )
| A. | Na+、SO42-、CO32-、OH- | B. | Mg2+、NH4+、Cl-、OH- | ||
| C. | Ca2+、Fe2+、H+、CO32- | D. | Fe3+、K+、SCN-、SO42- |
 .
.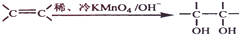 .请写出A与稀、冷的KMnO4溶液反应生成有机产物与足量醋酸反应的化学方程式为
.请写出A与稀、冷的KMnO4溶液反应生成有机产物与足量醋酸反应的化学方程式为 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$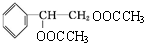 +2H2O.
+2H2O.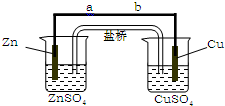 某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题: