题目内容
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
请回答:
(1)X2Z的电子式是______;M2Z中所含化学键类型是______.
(2)Y的非金属性比N______(填“强”或“弱”),能证明此结论的事实是______(用离子方程式表示).
(3)YX4的结构式为______;分子里各原子的空间分布具有______结构;在光照的条件下,将1molYX4与1molCl2混合充分反应后,得到的产物有______种.
(4)Y与X可形成原子个数为1:1的有机物,写出该有机物与氢气反应的方程式______.
| 元素 | 有关信息 |
| X | 在自然界中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要化合价为-2价 |
| M | 其单质及其化合物的焰色为黄色 |
| N | 与Y同主族,其单质为半导体材料 |
(1)X2Z的电子式是______;M2Z中所含化学键类型是______.
(2)Y的非金属性比N______(填“强”或“弱”),能证明此结论的事实是______(用离子方程式表示).
(3)YX4的结构式为______;分子里各原子的空间分布具有______结构;在光照的条件下,将1molYX4与1molCl2混合充分反应后,得到的产物有______种.
(4)Y与X可形成原子个数为1:1的有机物,写出该有机物与氢气反应的方程式______.
短周期元素X、Y、Z、M、N原子序数依次增大,X在自然界中原子半径最小,则X为氢元素;Y最外层电子数是次外层的2倍,则Y原子有2个电子层,最外层电子数为4,故Y为碳元素;M其单质及其化合物的焰色为黄色,则M为Na元素;Z元素的主要化合价为-2价,处于ⅥA族,原子序数小于钠元素,则Z为氧元素;N与Y同主族,其单质为半导体材料,则N为Si元素,
(1)H2O分子中氧原子与氢原子之间形成1对共用电子对,电子式为 ;Na2O中含有离子键,
;Na2O中含有离子键,
故答案为: ;离子键;
;离子键;
(2)同主族自上而下非金属性减弱,故非金属性C>Si,反应CO2+H2O+SiO32-=H2SiO3↓+CO32-,表明碳酸的酸性比硅酸强,可以说明C的非金属性强,
故答案为:强;CO2+H2O+SiO32-=H2SiO3↓+CO32-;
(3)CH4的结构式为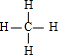 ;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1molYX4与1molCl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,
;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1molYX4与1molCl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,
故答案为: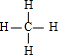 ;正四面体;5;
;正四面体;5;
(4)C与H可形成原子个数为1:1的有机物,该有机物为乙炔或苯,乙炔与氢气发生完全加成反应反应生成乙烷,反应方程式CH≡CH+H2
CH3CH3,苯与氢气发生加成反应生成环己烷,反应方程式为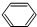 +3H2
+3H2
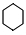 ,
,
故答案为:CH≡CH+H2
CH3CH3或 +3H2
+3H2
 .
.
(1)H2O分子中氧原子与氢原子之间形成1对共用电子对,电子式为
 ;Na2O中含有离子键,
;Na2O中含有离子键,故答案为:
 ;离子键;
;离子键;(2)同主族自上而下非金属性减弱,故非金属性C>Si,反应CO2+H2O+SiO32-=H2SiO3↓+CO32-,表明碳酸的酸性比硅酸强,可以说明C的非金属性强,
故答案为:强;CO2+H2O+SiO32-=H2SiO3↓+CO32-;
(3)CH4的结构式为
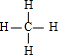 ;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1molYX4与1molCl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,
;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1molYX4与1molCl2混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,故答案为:
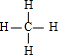 ;正四面体;5;
;正四面体;5;(4)C与H可形成原子个数为1:1的有机物,该有机物为乙炔或苯,乙炔与氢气发生完全加成反应反应生成乙烷,反应方程式CH≡CH+H2
| 一定条件 |
 +3H2
+3H2| Ni |
| △ |
 ,
,故答案为:CH≡CH+H2
| 一定条件 |
 +3H2
+3H2| Ni |
| △ |
 .
.
练习册系列答案
相关题目